- 1.98 MB
- 2022-08-16 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
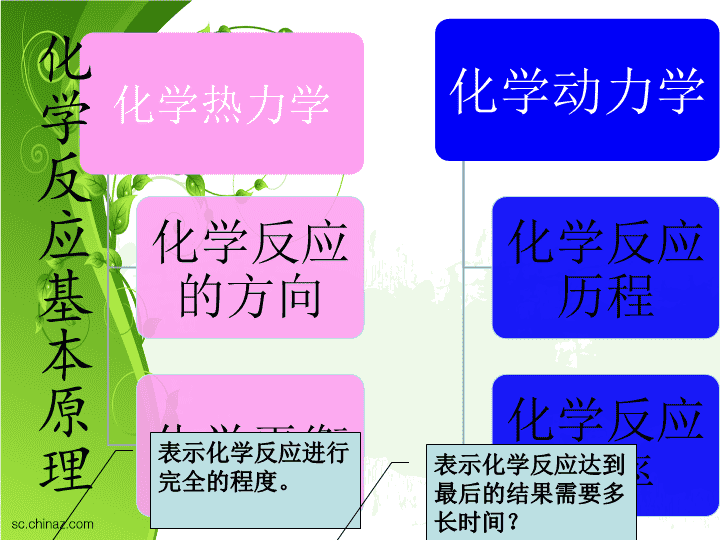
第三章化学反应速率\n化学热力学化学反应的方向化学平衡化学动力学化学反应历程化学反应速率化学反应基本原理表示化学反应进行完全的程度。表示化学反应达到最后的结果需要多长时间?\n化学热力学和化学动力学解决的问题不同,二者绝不能混淆!从ΔGθ的数值可知:当参加这两个反应的物质均处于标准状态时,第一个反应的趋势大于第二个反应的趋势。而实际上:我们将氢气和氧气放在一个容器中,好几年也不会生成水。而第二个反应却可以瞬间完成。这说明:反应趋势大,不代表反应速率大:也即化学热力学不能解决化学反应速率问题。\n4化学反应速率表示方法化学反应速率理论影响化学反应速率的因素本章主要内容\n53.1化学反应速率的概念什么是化学反应速率?化学反应速率是指在一定条件下,化学反应中反应物转变为生成物的快慢程度。因此,化学反应速率可用参加反应的物质的浓度(对气体可用分压)随时间的变化率来表示。也即用单位时间内反应物浓度的减少或者生成物浓度的增加来表示。化学反应速率的两种表示方法:平均速率和瞬时速率\n61.平均反应速率\n7例如,在某条件下,将2.10molL–1N2O5放入1L的容器中加热分解,测得数据如下:2N2O5(g)==4NO2(g)+O2(g)开始浓度(molL–1):2.1000200s末浓度(molL–1):1.700.800.20则反应开始后200s内,用N2O5、NO2或O2表示的平均反应速率分别为:\n8出现问题:同一个化学反应的平均反应速率,用不同的反应物或生成物浓度变化表示时,所得到的数值可能是不同的。解决办法:将上面各物质的反应速率除以其在反应式中的化学计量数,来表示该反应的平均速率。用公式表示如下:\n\n平均速率表示法的缺点:大部分反应都不是等速的,因此每个时间间隔内的速率都不一样。一般来说,开始阶段反应速率较快,随着反应的进行,反应物的浓度不断减少,生成物的浓度不断增加,反应速率会逐渐降低。故平均速率不能确切地反映速率变化的真实情况,只提供了一个平均值。解决办法:采用瞬时的浓度变化精确表示化学反应在某一指定时刻的速率,即瞬时速率,可以反映出更真实的反应速率。\n2、瞬时反应速率是指反应在某一瞬间的反应速率。即平均速率的极限值。用公式表示如下:瞬时反应速率的实质:浓度对时间的一阶导数\n3、瞬时反应速率的作图测定用物理或化学法测定不同时刻某组分(反应物或生成物)的浓度c(i)以时间t为横坐标,以浓度c为纵坐标作图,把各点用平滑的曲线连接起来,得到该组分浓度随时间的变化曲线,即c-t曲线从曲线上作某时刻t对应曲线的切线,其斜率即为该时刻的瞬时反应速率\n13图3-1反应物或产物浓度随时间的变化曲线\n4、反应历程定义:一个化学反应在一定条件下由反应物变成生成物具体经历的途径、步骤称为反应历程或反应机理。反应历程与化学方程式的关系:通常写的化学反应方程式往往只能表明反应的总结果,并不能说明从反应物转变为生成物所经历的途径。反应历程的举例说明:对于化学反应H2(g)+Cl2(g)2HCl(g)研究发现,该反应在光照条件下是由下列四个步骤完成的:Cl2(g)+M2Cl(g)+M(1)Cl(g)+H2(g)HCl(g)+H(g)(2)H(g)+Cl2(g)HCl(g)+Cl(g)(3)Cl(g)+Cl(g)+MCl2(g)+M(4)上述四个步骤的每一步反应都是由反应物分子(或原子、离子及自由基等)直接发生相互作用而转变成生成物分子。因此称作一个基元反应。这四个基元反应组成了由反应物转变成生成物的反应历程。\n5.基元反应和非基元反应基元反应定义:一步就能完成的反应叫做基元反应(或简单反应)举例:2NO2(g)==2NO(g)+O2(g)CO(g)+NO2(g)==CO2(g)+NO(g)非基元反应定义:由两个或两个以上基元反应构成的反应称为非基元反应(或复杂反应)举例:合成HI的反应:H2(g)+I2(g)==2HI(g)\n对于复杂反应来说,其反应速率是由最慢一步基元反应的反应速率决定的,因此,复杂反应中最慢的一步基元反应是该复杂反应的定速步骤。例如复杂反应H2(g)+I2(g)==2HI(g)该反应由下列两个基元反应组成:第一步I2→2I(快反应)第二步H2+2I→2HI(慢反应)第一步是快反应,很快就能达到平衡,第二步是慢反应,它决定着整个反应的速率,因此,第二步为定速步骤。\n6、化学反应的速率方程式定义:表示反应速率和反应物浓度之间定量关系的方程式形式:对于一般反应:aA+bB=cC+dD速率方程式如下反应级数:速率方程式中各反应物浓度的幂指数之和(x+y)称为该反应的反应级数(n)。其中x和y分别称为反应对A和B的级数。例如:若x=1,y=2.则该反应对于A为一级反应,对于B为二级反应,该反应的反应级数为3。反应级数表示反应物浓度对反应速率的影响程度。级数越高,则该物质浓度的变化对反应速率的影响越显著;零级反应表示反应速率与反应物浓度无关;如果级数是负数,则表示该物质浓度增加抑制了反应的进行,使反应速率下降。\n确定速率方程式的一种简单方法——改变物质数量比例法。\n7.基元反应的速率方程——质量作用定律定律内容:在一定温度下,基元反应(包括复杂反应中的任一基元步骤)的化学反应速率与各反应物浓度以方程式中化学计量数的绝对值为幂指数的乘积成正比,这个规律称为质量作用定律。数学表达式:对一般的基元反应:aA+bB=cC+dD\n关于质量作用定律要注意:1、质量作用定律只适用于基元反应,不适用于非基元反应。2、质量作用定律表达式中反应物的浓度是指气态和溶液中反应物的浓度,而固态或纯液态反应物的浓度不写入速率方程式,这是因为它们的浓度可以看作常数,其浓度对反应速率的影响已包含在反应速率常数k中了。例如基元反应:C(s)+O2(g)==CO2(g)速率方程式可写为:v=kc(O2)3、对于气体反应,质量作用定律表达式中反应物的浓度可用分压来表示。例如气相基元反应:2NO2(g)2NO(g)+O2(g)用浓度表示时,其速率方程式为:v=kcc2(NO2)用分压表示时,其速率方程式为:v=kpp2(NO2)但要注意,两种表示方法中的速率常数kc和kp的数值和单位都是不同的。4、对于非基元反应,质量作用定律仅适用于每一个基元步骤。5、质量作用定律表达式中的反应级数与它们的化学计量数是一致的。\n8.非基元反应速率方程的写法—定速步骤表示法也即速率方程式可用最慢一步基元反应的反应速率来表示例如非基元反应:HIO3+3H2SO3==HI+3H2SO4经实验考证该反应分两步进行:第一步基元反应HIO3+H2SO3==HIO2+H2SO4(慢反应)第二步基元反应HIO2+2H2SO3==HI+2H2SO4(快反应)对整个反应来说,第一步(慢反应)是控速步骤,因此整个反应的速率方程式可根据第一步来书写:v=kc(HIO3)c(H2SO3)因此,该反应的反应级数不是4,而是2。\n实验编号c(A)/(mol·L-1)c(B)/(mol·L-1)υ(mol·L-1·s-1)10.100.100.01220.200.100.02430.100.200.048(1)写出该反应的速率方程式并指出其反应级数;(2)求出该反应的速率常数k;(3)计算当c(A)=0.15mol·L-1,c(B)=0.15mol·L-1时的反应速率。\n23(2)将表中任一实验数据(如第1组)代入速率方程式,即:0.012mol·L-1·s-1=k(0.10mol·L-1)(0.10mol·L-1)2解得k=12mol-2.·L2·s-1(3)当c(A)=0.15mol·L-1,c(B)=0.15mol·L-1时υ=12mol-2.·L2·s-1×0.15mol·L-1×(0.15mol·L-1)2=0.0405mol·L-1·s-1\n243.2化学反应速率理论碰撞理论提出人:路易斯理论基础:气体分子运动论过渡状态理论提出人:艾林和波拉尼理论基础:统计力学和量子力学\n251、有效碰撞理论化学反应发生的先决条件反应物分子间的碰撞化学反应发生的充分条件反应物分子间的有效碰撞化学反应的实质是旧键的断裂和新键的形成,而旧键断裂和新键形成只有通过反应物分子的相互碰撞才有可能实现。因此,反应物分子碰撞的频率越高,反应速率就越快。在无数次的分子碰撞中,大多数的分子碰撞是无效的,只有极少数的分子碰撞是有效的,才能引起化学反应的发生。这种能够引起化学反应发生的碰撞称为有效碰撞\n26反应物分子要发生有效碰撞必须具备两个前提条件:发生有效碰撞的反应物分子必须具有足够高的能量。因为化学反应是旧的化学键断裂和新的化学键形成的过程,只有具备足够能量的反应物分子在相互碰撞时才有可能克服原子间的结合能,使旧的化学键断裂,从而导致分子中原子的重排,形成新的化学键,即发生化学反应。这些具有足够高的能量,能够发生有效碰撞的分子称为活化分子。发生有效碰撞的反应物分子之间必须有恰当的取向。只有当参加反应的活化分子采取合适的取向进行碰撞时,才能使相应的原子相互接触,碰撞才是有效的,反应才能发生。如果碰撞方位不对头,就不能发生反应。\n27活化能定义:活化分子的平均能量与所有反应物分子的平均能量之差。实质:是化学反应的“能垒”。活化能越小,则活化分子在反应物总分子中所占的百分数就越大,有效碰撞次数就越多,反应速率就越快;反之,活化能越大,活化分子所占的百分数就越小,有效碰撞次数就越少,反应速率就越慢。例如:活化能小于40kJ·mol-1的反应瞬间就能完成;活化能大于400kJ·mol-1的反应,其速度非常慢。图示:气体分子能量分布曲线。图3-2气体分子能量分布曲线\n28由上面讨论可知,反应速率取决于以下三种因素:写成公式为:v=ZPf,其中:碰撞频率Z能量因子f,又称分子有效碰撞分数方位因子P\n碰撞理论的成功与局限:成功之处直观明了,比较成功地解释了某些简单反应。局限性对于分子结构复杂的反应,由于它只把分子看作简单的刚性球,把分子间的相互作用看成简单的机械碰撞,因而不能圆满的给予解释\n2、过渡状态理论理论要点:当两个活化分子按一定的方位相互碰撞时,分子中的化学键发生重排,能量要重新分配,即反应物分子必须先经过一个中间过渡状态,形成一种活化配合物,然后再转化为产物。在活化络合物中,旧键未完全断裂,新键也未完全形成。这种活化配合物的能量很高,因此非常不稳定,一经形成很快就会分解,既可以分解为生成物,也可以重新变回原来的反应物。由于过渡状态的能量既高于始态,也高于终态,因此形成了一个能峰,这个能峰的高度,就是反应的活化能。\n31图3-4反应过程中的势能变化图\n32活化能与反应热之间的关系:∵Ea(正)=E(*)-E(Ⅰ)Ea(逆)=E(*)-E(Ⅱ)∴△H=E(Ⅱ)-E(Ⅰ)=Ea(正)-Ea(逆)。当Ea(正)>Ea(逆)时,△H>0,正反应为吸热反应;当Ea(正)<Ea(逆)时,△H<0,正反应为放热反应。对任一可逆反应,正反应放热,逆反应必定吸热;反之,正反应吸热,逆反应必定放热。\n333.3影响化学反应速率的因素影响化学反应速率的因素内因反应物的本性外因浓度(压力)温度催化剂\n34增加反应物浓度时单位体积内反应物的分子总数增加活化分子的数目也会相应增加单位体积、单位时间内有效碰撞次数增加反应速率加快1、浓度对反应速率的影响对于一确定的化学反应,在一定温度下,反应物分子中活化分子所占的百分数是一定的。\n35温度升高分子的运动速度加快单位时间内的碰撞总次数增加分子的能量增加大量的非活化分子获得能量变成活化分子单位体积内活化分子的百分数明显增大2、温度对反应速率的影响\n36(1)范特霍夫近似经验规则(2)阿仑尼乌斯公式\n37