- 679.82 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019学年度高三第六次诊断考试
化 学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5
Fe 56 Cu 64 Au 197
第I卷
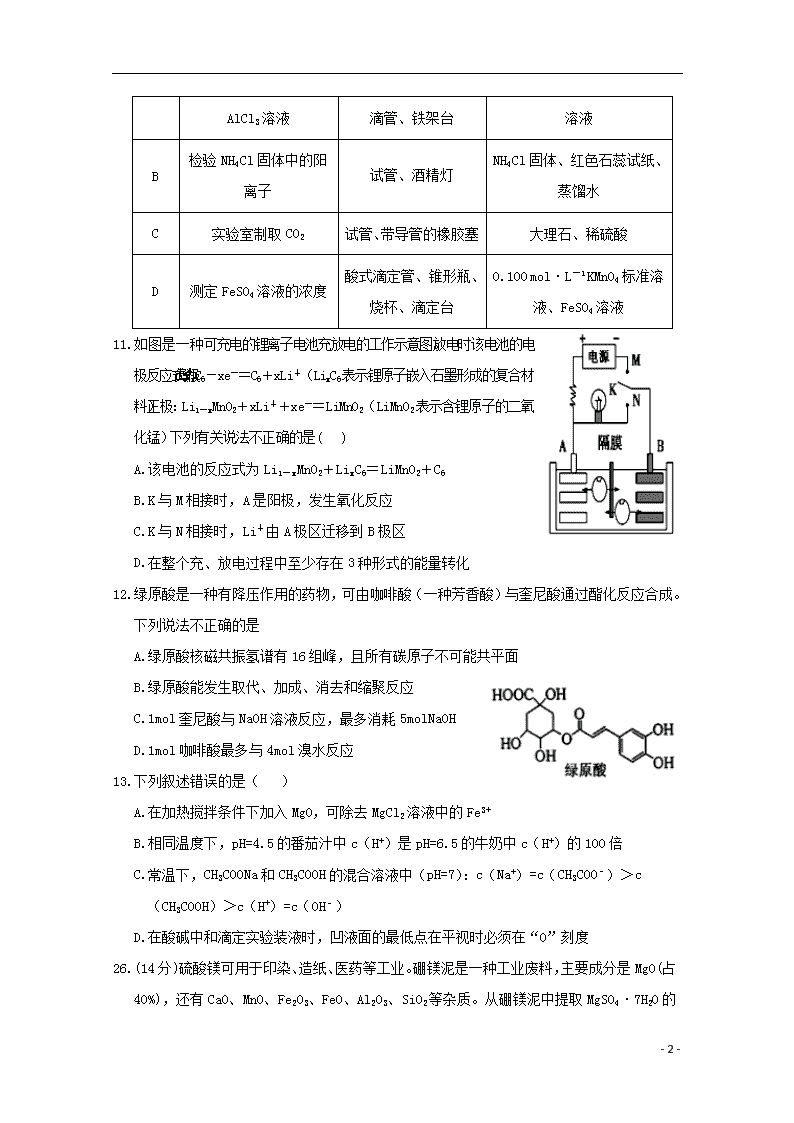
一、选择题:(共 13小题,每小题6分,共78分,每小题只有一个选项正确,有选错的或不答的得0分)
7.下列说法错误的是
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.盐酸、福尔马林、漂粉精、碱石灰都是混合物
C.直径在10-9 ~ 10-7m的NaCl固体小颗粒分散到水中能形成胶体
D.“陶成雅器”的主要原料是黏土
8.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2L氧气所含的氧原子数为NA
B.46gNO2和N2O4混合物含有的原子数为3 NA~6 NA之间
C.1mol·L-1的CaCl2溶液中含有的Cl-为2NA
D.1mol羟基中含有的电子数为9NA
9.W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不正确的是
A.原子半径:X>Y>Z>W
B.Y位于第三周期第ⅢA族
C.W和X组成的化合物一定是碱性氧化物
D.向W、X、Y组成化合物的水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
10.为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( )
选项
实验目的
主要仪器
所用试剂
A
提纯混有MgCl2
待提纯的AlCl3
- 7 -
杂质的AlCl3溶液
烧杯、分液漏斗、胶头滴管、铁架台
溶液、NaOH溶液
B
检验NH4Cl固体中的阳离子
试管、酒精灯
NH4Cl固体、红色石蕊试纸、蒸馏水
C
实验室制取CO2
试管、带导管的橡胶塞
大理石、稀硫酸
D
测定FeSO4溶液的浓度
酸式滴定管、锥形瓶、烧杯、滴定台
0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液
11.如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是( )
A.该电池的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B.K与M相接时,A是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充、放电过程中至少存在3种形式的能量转化
12.绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法不正确的是
A.绿原酸核磁共振氢谱有16组峰,且所有碳原子不可能共平面
B.绿原酸能发生取代、加成、消去和缩聚反应
C.1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
D.1mol咖啡酸最多与4mol溴水反应
13.下列叙述错误的是( )
A.在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+
B.相同温度下,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO﹣)>c(CH3COOH)>c(H+)=c(OH﹣)
D.在酸碱中和滴定实验装液时,凹液面的最低点在平视时必须在“0”刻度
26.(14分)硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2
- 7 -
O的流程如下:
(1)实验中需用3mol·L-1的硫酸500mL,若用98%的浓硫酸(ρ=1.84g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为( )Mn2++( )ClO-+( )===( )MnO2↓+( )+( ),补充完整上述反应;还有一种离子也会被NaClO氧化,该反应的离子方程式为_______________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有____________ ____。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100g水):
温度/℃
40
50
60
70
MgSO4
30.9
33.4
35.6
36.9
CaSO4
0.210
0.207
0.201
0.193
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_____。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,_________,便得到了MgSO4·7H2O。
27.(14分)为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2 获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H1=-76.0kJ/mol
0.80
0
10
t/min
C(CH4)/mol·L-1
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=+113.4kJ/mol
(1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=______。
(2)在反应i中,每放出38.0kJ热量,有_______gFeO 被氧化。
- 7 -
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2 和8molH2,发生反应:CO2(g) +4H2(g)CH4(g) +2H2O(g) △H4,混合气体中CH4 的浓度与反应时间的关系如图所示。
(3)①从反应开始到恰好达到平衡时,H2 的平均反应速率v(H2) =_________。
②300℃时,反应的平衡常数K=____________。
③300℃时,向1L恒容密闭容器中充入2molCO2 和8molH2,发生反应,请在右图中画出c(CH4)随时间t变化趋势图。
④300℃时,从反应开始至建立平衡的过程中容器中气体的密度 (填增大、减小或不变)。
(4)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则△H4______0(填“>”“<”或“=”)。
28.(15分)苯佐卡因(对氨基苯甲酸乙酯)常用于创面、溃疡面及痔疮的镇痛。在实验室用对氨基苯甲酸()与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
相对分子质量
密度
(g·cm-3)
熔点/℃
沸点/℃
溶解性
乙醇
46
0.79
-114.3
78.5
与水任意比互溶
对氨基苯甲酸
137
1.374
188
399.9
微溶于水,易溶于乙醇
对氨基苯甲酸乙酯
165
1.039
90
172
难溶于水,易溶于醇、醚类
产品合成: 在250mL圆底烧瓶中加入8.2g对氨基苯甲酸(0.06mol) 和80mL无水乙醇(约1.4mol),振荡溶解,将烧瓶置于冰水浴并加入10mL浓硫酸,将反应混合物在80℃水浴中加热回流1h,并不时振荡。
分离提纯: 冷却后将反应物转移到400mL烧杯中,分批加入10%Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714g·cm-3
- 7 -
) 分两次萃取,并向醚层加入无水硫酸镁,蒸出醚层,冷却结晶,最终得到产物3.3g。
(1)仪器A的名称为______,在合成反应进行之前,圆底烧瓶中还应加入适量的______。
(2)分液漏斗使用之前必须进行的操作是__ _____,乙醚层应从分液漏斗______口放出;分离提纯操作加入无水硫酸镁的作用是___ ______。
(3)合成反应中加入远过量的乙醇目的是__ _____;分离提纯过程中加入10%Na2CO3溶液的作用是__ _____ 。
(4)本实验中苯佐卡因的产率为_________(保留3位有效数字)。该反应产率较低的原因是_________ (填标号)。
a.浓硫酸具有强氧化性和脱水性,导致副反应多 b.催化剂加入量不足
c.产品难溶于水,易溶于乙醇、乙醚 d.酯化反应是可逆反应
35.(15分)[化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S 电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有_______,[Cu(NH3)4]2+ 的结构简式为_______,阴离子中心原子杂化类型为______。
②氨的沸点远高于膦(PH3),原因是______________。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因____________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。
①该合金的化学式为____;
②已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。
36.(15分)[化学一选修5:有机化学基础]用石油产品烃A(质谱如图1)为主要原料,合成具有广泛用途的有机玻璃PMMA。流程如图2(部分产物和条件省略)
- 7 -
试回答下列问题:
(1)B的名称________;X试剂为_______(写电子式);D中官能团名称____ ____。
(2)E→G的化学方程式为__ __,反应类型是_________。
(3)T是G的同分异构体,1molT与足量新制Cu(OH)2悬浊液反应最多生成2molCu2O沉淀,T的结构有________种(不含立体结构)。
(4)I是A的同系物,相对分子质量相差14, I存在顺反异构体,写出反式I的结构简式_____ __。
(5)参照上述流程,以为原料合成(其它原料自选)。设计合成路线:_______ _________________。
高三化学参考答案
7.C 8.D 9.C 10.D 11.C 12.C 13.D
26.(14分每空2分) D H2O 2H+ Cl- 2Fe2++ClO-+2H+===2Fe3++Cl-+H2O MnO2 SiO2 取少量滤液,向其中加入紫色高锰酸钾溶液 ,若溶液紫色不变浅或褪色,则说明滤液中不含Fe2+;或者加入K3Fe(CN)6是否出现蓝色沉淀(加KSCN溶液与氯水不给分) 趁热过滤 过滤(或过滤洗涤)
27.(14分每空2分) +18.7kJ/mol 144 0.32 mol.L-1.min-1 25L2.mol-2 不变 <
- 7 -
28. (15分) 球形冷凝管(1分) 沸石(或碎瓷片) (1分) 检查是否漏液 (1分) 上 ; 干燥吸水;(2分) 作溶剂,提高对氨基苯甲酸的转化率; (2分) 中和过量的浓硫酸和调节pH ;(2分)33.3%(或33.4%);(2分) a d(2分)
35.(15分) 1 O、S、H 共价键、配位键、离子键 sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au)
36. 2—丙醇(或异丙醇)(1分) (2分) 羧基、羟基 (2分) (2分)酯化反应(或取代反应)(1分) 4 (2分) (2分)
(3分每步1分)
- 7 -
相关文档
- 高中化学第三章有机化合物3_1最简2021-07-027页
- 2020版高中化学 第一章第2节课时1 2021-07-027页
- 高中化学选修4第3章第1节 弱电解质2021-07-025页
- 2019高中化学 第四章 非金属及其化2021-07-025页
- 2020学年高中化学 第1章 原子结构 2021-07-0210页
- 高中化学第四章电化学基础2化学电2021-07-023页
- 2020高中化学第五章进入合成有机高2021-07-0213页
- 2019-2020学年高中化学同步学典7第2021-07-028页
- 高中化学必修1第1章第2节第2课时练2021-07-028页
- 高中化学人教版必修2(练习)3_3_2 乙2021-07-0215页