- 332.86 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
7.习近平总书记在上海考察时指出,垃圾分类工作就是新时尚。下列垃圾分类错误的是
A. B.
C. D.
8.设 NA 为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LHF 中含有的极性键数目为 0.1NA
B.18 g 重氢氨基(-ND2)中含有的电子数为 10NA
C.33.6L 氯气与足量铝充分反应,转移电子数为 3NA
D.7g 乙烯和丙烯混合气体中的氢原子数为 NA
9.下列化学(或离子)方程式中,不能正确表达反应颜色变化的是
A.电解饱和食盐水产生黄绿色气体:2NaCl+2H2O=====
电解
2NaOH+H2↑+Cl2↑
B.红热木炭遇浓硝酸产生红棕色气体:C+4HNO3(浓)====
△
CO2↑+4NO2↑+2H2O
C.Na2O2 在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D . 向 Ca(ClO)2 溶 液 中 通 入 少 量 SO2 , 出 现 白 色 沉 淀
SO2+Ca2++3ClO−+H2O=CaSO4↓+2HClO+Cl−
10.一定条件下,密闭容器中的 H2 在催化剂的催化下可高效转化酸性溶液中的硝态氮(NO−3)
以达到消除污染的目的。其工作原理的示意图如下:
下列说法正确的是
A.导电基体上的正极产物仅有 NO 和 NH+4
B.若导电基体上的 Pt 颗粒增多,不利于降低溶液中的含氮量
C.若导电基体上只有单原子铜,NO −3能全部转化为 N2O
D.若 Ir 的表面处理 1mol N2O,理论上负极消耗 89.6L H2
11.X、Y、Z 均为短周期主族元素,Y 的核电荷数为奇数,Z 的
核电荷数为 X 的 2 倍。X 的最外层电子数等于 Y 与 Z 的最外层
电子数之和。Y 与 Z 同周期且 Y 的原子半径大于 Z。下列叙述
正确的是
A.单质的熔点:Y>Z B.X 的最高价氧化物的水化物为弱酸
C.Y、Z 的氧化物均为离子化合物 D.气态氢化物稳定性:X>Z
12.食品防腐剂 R 的结构简式如图所示: ,下列说法正确
的是
A.R 在空气中易被氧化且易溶于水
B.1 个 R 分子最多有 20 个原子共平面
C.能与 FeCl3 发生显色反应,苯环有 2 个取代基,且能发生水解反应 R 的同分异构体有 18
种
D.1 mol R 与 3 mol H2 反应生成的有机物分子式为 C9H18O3
13.常温时,向 H2C2O4(二元弱酸)溶液中滴加 NaOH 溶液,混合溶液中 lgX[X 表示
-
2 4
2 2 4
c( )
c(
HC O
H C O )
或
2-
2 4
-
2 4
C O
c(HC
c
O
( )
) ]随 pH 的变化关系如图所示。下列说法正确的是
A.PH=1.22 时混合溶液中 c(Na+)>c(HC2O−4)+2c(C2O2−4 )
B.0.1mol/L NaHC2O4 溶液中:c(OH−)>c(H+)
C.H2C2O4 的一级电离常数为 1×10−4.19
D.I 中 X 表示的是
-
2 4
2 2 4
c( )
c(
HC O
H C O )
26.(14 分)铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成线路如下图所示。
(1)已知无水 AlCl3 在潮湿的空气中极易水解。某实验小组利用下图中部分装置制备无水
AlCl3。
①实验小组的实验装置,按气流方向连接各仪器接口,顺序为: →fg。
②装置 E 的作用是 ,装置 F 中应盛装的试剂是
(2) AlCl3 与 NaH 反应时,需将 AlCl3 溶于有机溶剂,再将得到的溶液滴加到 NaH 粉末上,
此反应中 NaH 的转化率较低的可能原因是
(3)利用铝氢化钠遇水反应生成的氢气的体积测定铝氢化钠样品纯度。
①其反应的化学方程式为
②现设计如下四种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是 (填编号)(用代数式表示)
③取样品 ag,若实验测得氢气的体积为 Vml(标准状态),则铝氢化钠样品纯度为
(用代数式表示)
27.(14 分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究
价值。请回答下列问题:
(1)已知 CO 分子中化学键为 C≡O。相关的化学键键能数据如下:
化学键 H—O C≡O C=O H—H
E/(kJ·mol−1) 463 1075 803 436
CO(g)+H2O(g) CO2(g)+H2(g) ΔH=___________kJ·mol−1。
下列有利于提高 CO 平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中 H2O 的比例 d.使用高效催化剂
(2)用惰性电极电解 KOH 溶液,可将空气中的 CO2 转化为甲酸根(HCOO−),然后进一步
可以制得重要有机化工原料甲酸。CO2 发生反应的电极反应式为________________,若电解过
程中转移 1mol 电子,阳极生成气体的体积(标准状况)为_________L。
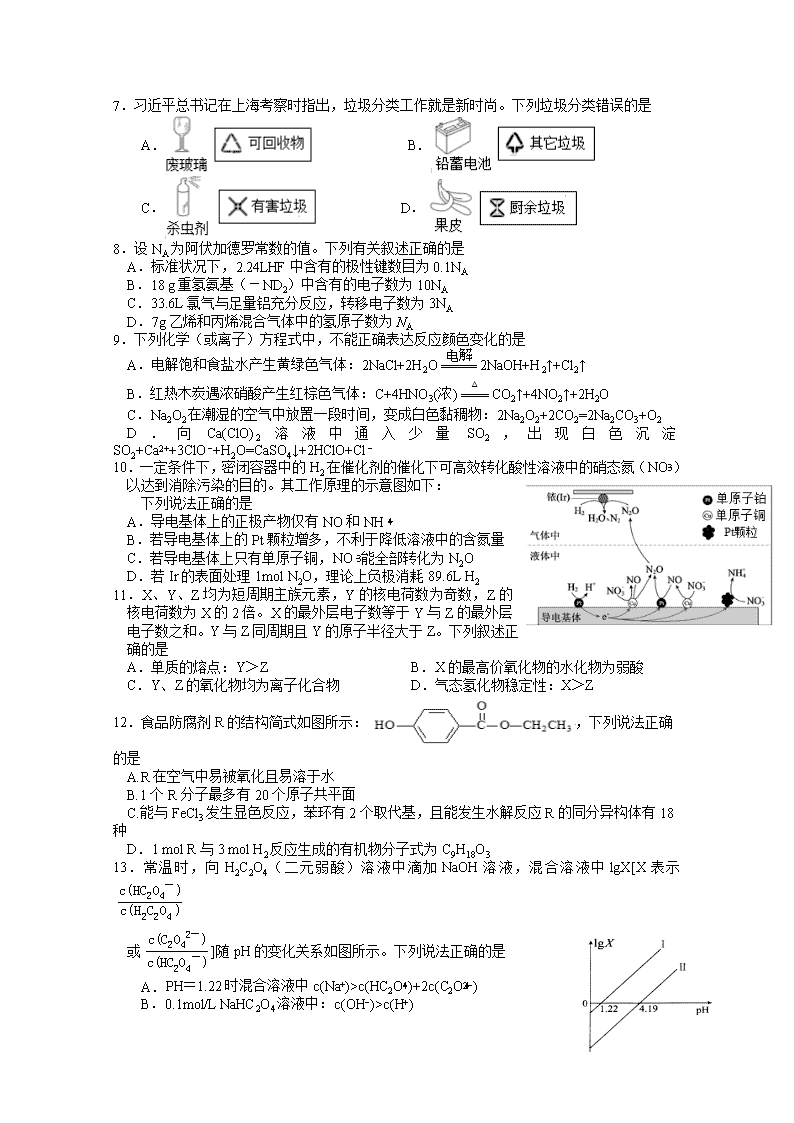
(3)乙苯催化脱氢制取苯乙烯的反应为:
(g)+CO2(g) (g)+CO(g)+H2O(g),其反应历程如下:
①一定温度下,向恒容密闭容器中充入 2mol 乙苯和 2mol
CO2,起始压强为 p0,平衡时
容器内气体总物质的量为 5mol,乙苯的转化率为_______,
用平衡分压代替平衡浓度表示的化学平衡常数 Kp=_______。
[气体分压(p 分)=气体总压(p 总)×气体体积分数]
②乙苯平衡转化率与 p(CO2)的关系如下图所示,请解释
乙 苯 平 衡 转 化 率 随 着 p(CO2) 变 化 而 变 化 的 原 因
________________________________________________。
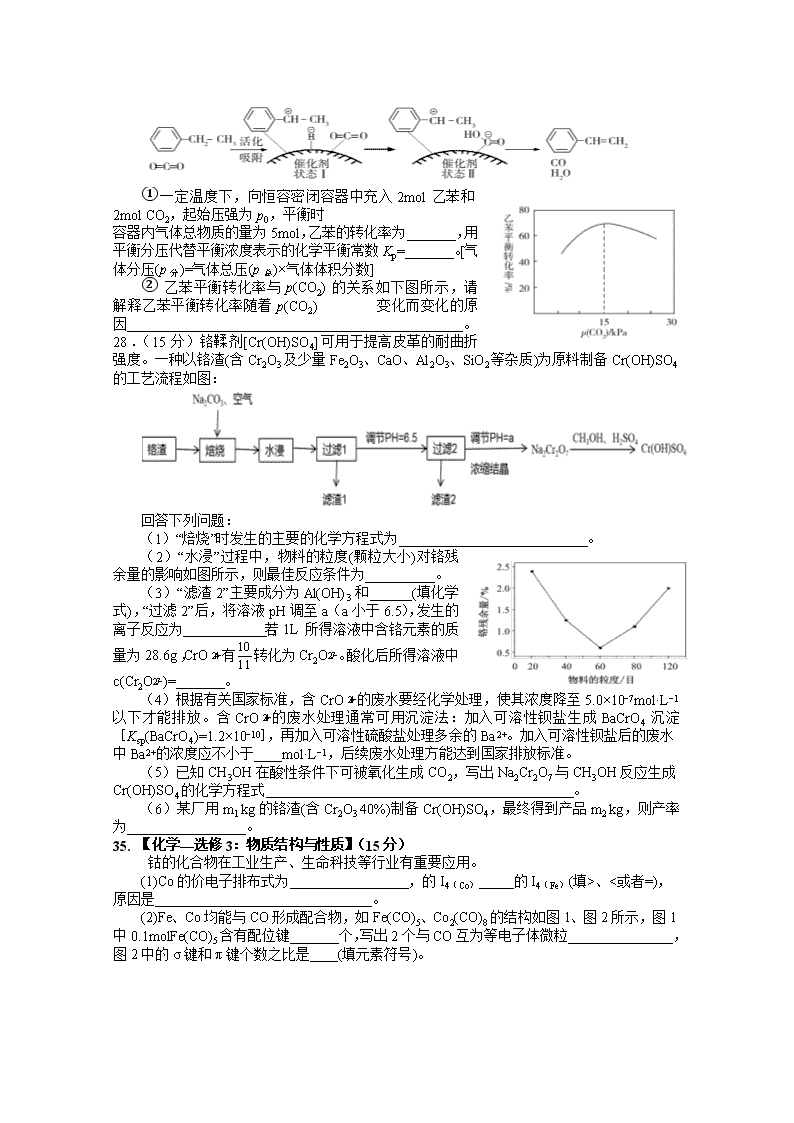
28.(15 分)铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强
度。一种以铬渣(含 Cr2O3 及少量 Fe2O3、CaO、Al2O3、SiO2 等杂质)为原料制备 Cr(OH)SO4 的
工艺流程如图:
回答下列问题:
(1)“焙烧”时发生的主要的化学方程式为___________________________。
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余
量的影响如图所示,则最佳反应条件为__________。
(3)“滤渣 2”主要成分为 Al(OH)3 和______(填化学
式),“过滤 2”后,将溶液 pH 调至 a(a 小于 6.5),发生的
离子反应为____________,若 1L 所得溶液中含铬元素的
质量为 28.6g,CrO 2−4 有10
11
转化为 Cr2O2−7 。酸化后所得溶
液中 c(Cr2O2−7 )=_______。
(4)根据有关国家标准,含 CrO 2−4 的废水要经化学处理,使其浓度降至 5.0×10−7mol·L−1
以下才能排放。含 CrO 2−4 的废水处理通常可用沉淀法:加入可溶性钡盐生成 BaCrO4 沉淀
[Ksp(BaCrO4)=1.2×10−10],再加入可溶性硫酸盐处理多余的 Ba2+。加入可溶性钡盐后的废水
中 Ba2+的浓度应不小于____mol·L−1,后续废水处理方能达到国家排放标准。
(5)已知 CH3OH 在酸性条件下可被氧化生成 CO2,写出 Na2Cr2O7 与 CH3OH 反应生成
Cr(OH)SO4 的化学方程式____________________________________________。
(6)某厂用 m1 kg 的铬渣(含 Cr2O3 40%)制备 Cr(OH)SO4,最终得到产品 m2 kg,则产率
为_________________。
35. 【化学—选修 3:物质结构与性质】(15 分)
钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co 的价电子排布式为_________________,的 I4(Co)_____的 I4(Fe)(填>、<或者=),
原因是_______________________________。
(2)Fe、Co 均能与 CO 形成配合物,如 Fe(CO)5、Co2(CO)8 的结构如图 1、图 2 所示,图 1
中 0.1molFe(CO)5 含有配位键_______个,写出 2 个与 CO 互为等电子体微粒_______________,
图 2 中的σ键和π键个数之比是____(填元素符号)。
(3) 金属钴的堆积方式为六方最密堆积,其配位数是_____________________;
该晶胞的边长为 x nm,高为 ynm,该晶胞的密度为_______________ g·cm-3。
(NA 表示阿伏加德罗常数的值,列出代数式)
36.【化学—选修 5:有机化学基础】(15 分)
化合物 W 是一种药物的中间体,一种合成路线如图:
已知:①
②
③ ;请回答下列问题:
(1)A 的系统命名为 。
(2)反应②的反应类型是 。
(3)反应⑥所需试剂和条件为 。
(4)写出反应③的化学方程式为 。
(5)写出 F 的结构简式: 。
(6)化合物 M 是 D 的同分异构体,则符合下列条件的 M 共有 种(不含立体异
构)。
①1mol M 与足量的 NaHCO3 溶液反应,生成二氧化碳气体 22.4L(标准状态下);
②0.5mol M 与足量银氨溶液反应,生成 108g Ag 固体
其中核磁共振氢谱为 4 组峰且峰面积比为 6∶2∶1∶1 的结构简式为 (写出其中一
种)。
(7)参照上述合成路线,以 C2H5OH 和 为起始原料,选用必要的无机试剂
合成 ,写出合成路线 。
高三校测(三)理科综合试卷化学部分参考答案
7.B 8.D 9.C 10.B 11.D 12.C 13.D
26. (14 分)(1)①a’→ih→de→bc(→fg)(2 分)
②吸收 Cl2 尾气并防止外界水蒸气进入(2 分); 饱和食盐水(2 分)
(2)反应生成的 NaCl 沉淀覆盖在 NaH 表面,阻止了反应的进行(2 分)
①NaAlH4 + 2H2O = NaAlO2 +4H2↑(2 分) ②乙(2 分) ③54V×10−3/89.6a(2 分)
27. (14 分) (1)−41 (2 分) bc (2 分)
(2) CO2+2e−+H2O=HCOO−+OH−(2 分) 5.6 (2 分)
(3) ① 50% (2 分) 0.25p0 (2 分)
② 随着 CO2 压强增大,CO2 浓度增大,乙苯平衡转化率增大;CO2 压强继续增大,
会造成催化剂表面乙苯的吸附率下降 (2 分)
28.(15 分)(1)2Cr2O3+4Na2CO3+3O2=====
高温
4Na2CrO4+4CO2 (2 分)
(2)物质的粒度为 60 目(1 分)
(3)H2SiO3(2 分) 2CrO2−4 +2H+ Cr2O2−7 +H2O(2 分) 0.25mol·L−1 (2 分)
(4)2.4×10−4 (2 分)
(5)Na2Cr2O7+CH3OH+3H2SO4=2Cr(OH)SO4+CO2+Na2SO4+4H2O (2 分)
(6) 2
1
38 100%33
m
m
(2 分)
35.(1)3d74S2 (1 分) < (1 分)
Co 失去三个电子后会变成[Ar]3d6,更容易再失去一个电子形成半满状态[Ar]3d5,
Fe 失去三个电子后会变成[Ar]3d5,达到半充满的稳定状态,更难再失去一个电子(2 分)
(2)6.02×1023 (或 NA)(2 分) N2、CN-(2 分) 19:14 (2 分)
(3)12 (2 分)
21
2
A
236 3 10
3 Na c
(3 分)
36. (15 分)(1)2,3-二甲基-1,3 丁二烯 (2 分)
(2)氧化反应(1 分) (3)浓氢溴酸 、加热 (1 分)
(4) + +CH3COOH (2 分)
(5)(CH2OH)3CCHO (2 分)
(6)12 (2 分) (2 分)
(7) (3 分)
3x2yNA