- 268.68 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
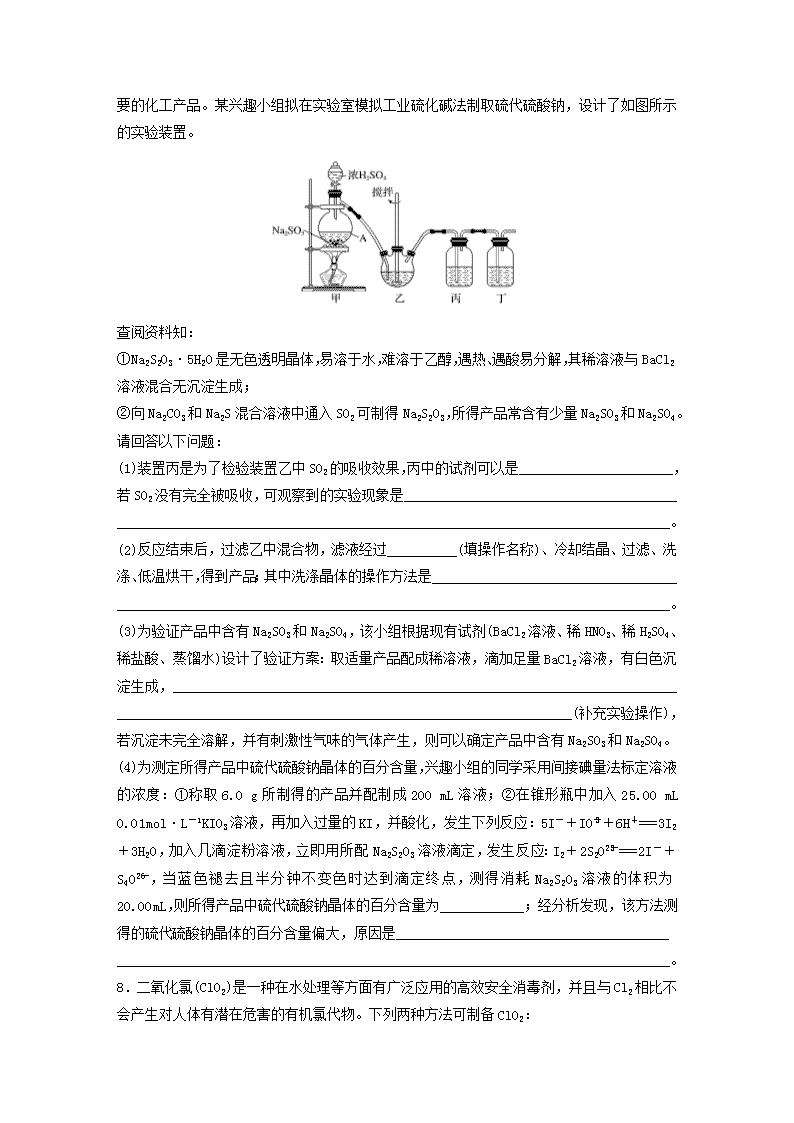
微题型12题型一 “电子转移守恒法”在计算中的应用1.(2018·豫北名校联考)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3K2O+5Na2O+16N2↑。下列有关说法正确的是( )A.KNO3是氧化剂,Na2O是还原产物B.1molNaN3完全反应时转移3mol电子C.若氧化产物比还原产物多1.75mol,则生成44.8LN2(标准状况)D.若有65gNaN3参加反应,则被还原的N的物质的量为0.1mol2.(2019·佛山质检)在含有0.078molFeSO4的溶液中通入0.009molCl2,再加入含有0.01molX2O的溶液后,Fe2+恰好完全转化为Fe3+,则反应后X元素的化合价为( )A.+2B.+3C.+4D.+53.(2018·福建普高模拟)已知M2O可与R2-作用,R2-被氧化为R单质,M2O的还原产物中,M为+3价;又知100mLc(M2O)=0.3mol·L-1的溶液可与150mLc(R2-)=0.6mol·L-1的溶液恰好完全反应,则n值为( )A.4B.5C.6D.74.(2019·山西联考)羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL0.049mol·L-1羟胺的酸性溶液与足量硫酸铁溶液煮沸反应,生成的Fe2+恰好与24.55mL0.020mol·L-1的酸性KMnO4溶液完全反应。已知(未配平):FeSO4+KMnO4+H2SO4―→Fe2(SO4)3+K2SO4+MnSO4+H2O,则羟胺的氧化产物是( )A.N2B.N2OC.NOD.NO25.(2018·吉林重点中学期中)已知S2O和H2O2一样含有过氧键,因此也有强氧化性,S2O在一定条件下可把Mn2+氧化为MnO,若反应后S2O被还原生成SO,又知氧化剂和还原剂的离子数之比为5∶2,则S2O中的n和S元素化合价分别是( )A.2,+6B.2,+7C.4,+6D.4,+7题型二 “关系式法”在计算中的应用6.[2015·全国卷Ⅰ,36(6)]准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O被还原为Cr3+。样品中CuCl的质量分数为________。7.(2018·贵阳市高三期末)硫代硫酸钠(Na2S2O3)俗名“大苏打”,又称为“海波”,是一种n重要的化工产品。某兴趣小组拟在实验室模拟工业硫化碱法制取硫代硫酸钠,设计了如图所示的实验装置。查阅资料知:①Na2S2O3·5H2O是无色透明晶体,易溶于水,难溶于乙醇,遇热、遇酸易分解,其稀溶液与BaCl2溶液混合无沉淀生成;②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。请回答以下问题:(1)装置丙是为了检验装置乙中SO2的吸收效果,丙中的试剂可以是______________________,若SO2没有完全被吸收,可观察到的实验现象是______________________________________________________________________________________________________________________。(2)反应结束后,过滤乙中混合物,滤液经过__________(填操作名称)、冷却结晶、过滤、洗涤、低温烘干,得到产品;其中洗涤晶体的操作方法是__________________________________________________________________________________________________________________。(3)为验证产品中含有Na2SO3和Na2SO4,该小组根据现有试剂(BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水)设计了验证方案:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________________________________________________________________________________________________________________(补充实验操作),若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4。(4)为测定所得产品中硫代硫酸钠晶体的百分含量,兴趣小组的同学采用间接碘量法标定溶液的浓度:①称取6.0g所制得的产品并配制成200mL溶液;②在锥形瓶中加入25.00mL0.01mol·L-1KIO3溶液,再加入过量的KI,并酸化,发生下列反应:5I-+IO+6H+===3I2+3H2O,加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O===2I-+S4O,当蓝色褪去且半分钟不变色时达到滴定终点,测得消耗Na2S2O3溶液的体积为20.00mL,则所得产品中硫代硫酸钠晶体的百分含量为____________;经分析发现,该方法测得的硫代硫酸钠晶体的百分含量偏大,原因是______________________________________________________________________________________________________________________。8.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,并且与Cl2相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO2:n方法一:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O。方法二:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O。(1)关于方法一的下列说法中正确的是______(填字母)。A.H2SO4是氧化剂B.NaClO3被还原C.H2O2是还原剂D.ClO2中Cl为+2价(2)方法二中被还原物质与被氧化物质的物质的量之比是________,若反应中产生的ClO2气体在标准状况下的体积为3.36L,则转移电子________mol。(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定Cl-与ClO的物质的量浓度之比为9∶1,则所得溶液中c(ClO)∶c(ClO-)=________。n答案精析1.C2.B [假设反应后X元素的化合价为+m价,根据得失电子数相等,得0.078×1=0.009×2+0.01×2×(6-m),解得m=3。]3.D [n(M2O)=0.3mol·L-1×0.1L=0.03mol,n(R2-)=0.6mol·L-1×0.15L=0.09mol,反应中M被还原,化合价降低到+3价,R元素被氧化,化合价升高到0价。设M2O中M的化合价为x,则2x+2=2n,x=n-1,氧化还原反应中氧化剂和还原剂转移电子数目相等,则有(n-1-3)×0.03mol×2=[0-(-2)]×0.09mol,n=7。]4.B [根据题意,可以认为羟胺被酸性KMnO4氧化,羟胺中N元素的化合价是-1,设羟胺的氧化产物中N元素的化合价是x,根据得失电子守恒,存在25.00×10-3L×0.049mol·L-1×(x+1)=24.55×10-3L×0.020mol·L-1×5,解得x≈1,故羟胺的氧化产物为N2O。]5.A [首先,根据S元素的最高化合价为+6即可排除B、D项。Mn2+被氧化成MnO,Mn元素的化合价由+2升高至+7,Mn2+为还原剂,已知S2O中含有过氧键,反应后生成SO,过氧键中氧元素化合价降低,S2O为氧化剂,结合S2O与Mn2+的离子数之比为5∶2,可写出离子方程式:8H2O+5S2O+2Mn2+===2MnO+10SO+16H+,根据电荷守恒得-5n+2×2=(-1)×2+(-2)×10+1×16,解得n=2,故选A。]6.%解析 CuCl被FeCl3溶液氧化为Cu2+,FeCl3被还原为Fe2+,利用K2Cr2O7滴定Fe2+,根据电子得失守恒有:CuCl~FeCl3~K2Cr2O7,w(CuCl)=×100%=%。7.(1)品红溶液(溴水或酸性高锰酸钾溶液等合理答案均可) 丙中溶液的颜色会变浅或褪色(2)蒸发浓缩 沿玻璃棒向漏斗中加乙醇直至浸没晶体,待乙醇自然流完后,重复操作2~3次(3)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸(4)62% 所制备的晶体中含有Na2SO3,Na2SO3也会与碘发生反应8.(1)BC (2)1∶1 0.15 (3)1∶4解析 (1)H2SO4中各元素的化合价未发生变化,A项错误;NaClO3中氯元素的化合价是+5,ClO2中氯元素的化合价是+4,反应中NaClO3被还原,B项正确、D项错误;H2O2中氧元素的化合价为-1,O2中氧元素的化合价为0,H2O2发生氧化反应,作还原剂,C项正确。(2)根据“化合价只靠拢不交叉”可知,NaClO3中氯元素的化合价由+5降为+4,HCl中氯元素的化合价由-1升高到0,反应中有一半HCl起酸的作用,氧化剂与还原剂的物质的量之比为1∶1。标准状况下3.36LClO2的物质的量为0.15mol,反应中转移电子0.15mol。(3)Cl2、NaCl、NaClO、NaClO3中氯元素的化合价分别为0、-1、+1、+5,混合液中Cl-n与ClO的物质的量浓度之比为9∶1,根据得失电子守恒可知ClO与ClO-的物质的量浓度之比为1∶4。