- 294.55 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
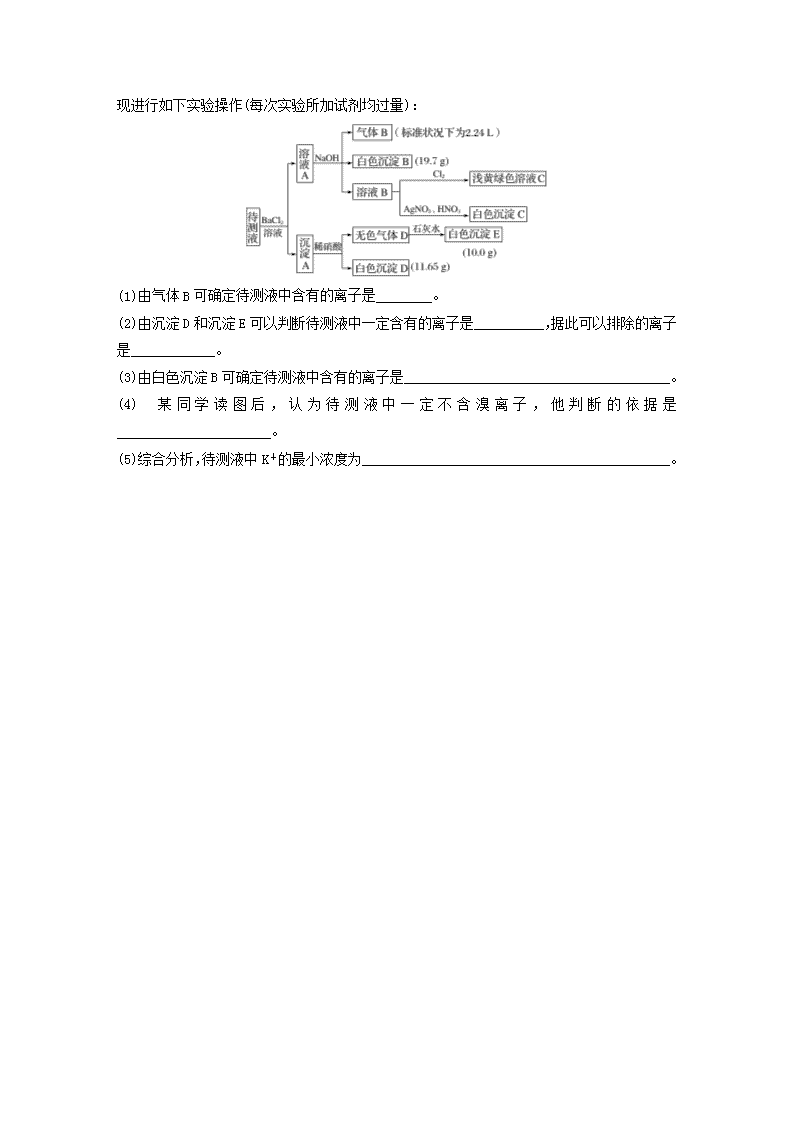
微考点8题型一 “定性型”离子检验与推断1.(2018·江西八校联考)某溶液中可能含有Na+、NH、Ba2+、SO、I-、S2-中的几种。①用pH试纸测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是( )A.Na+B.SOC.Ba2+D.NH2.某溶液含有K+、Fe3+、SO、CO、I-中的几种。取样,滴加KSCN溶液后显红色。下列有关原溶液的说法不正确的是( )A.一定存在的离子为Fe3+、SOB.一定不存在的离子为CO、I-C.不能确定的离子为K+、SOD.确定是否含有K+需要经过焰色反应3.(2019·昆明质检)某溶液仅有K+、Al3+、Mg2+、NH、Cl-、SO、HCO中的几种。为确定其成分,做如下实验:①取部分溶液。加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是( )A.肯定有Al3+、Cl-,一定没有HCO和SOB.肯定有Al3+、Mg2+、Cl-,可能有NH、K+C.肯定有Al3+、NH、Cl-,肯定没有HCOD.该溶液可能显弱酸性,也可能显中性题型二 “定量型”离子检验及推断4.(2018·德阳三校联考)在Na+浓度为0.9mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:阳离子K+、Ag+、Mg2+、Ba2+阴离子NO、CO、SiO、SO取该溶液100mL进行如下实验(气体体积在标准状况下测定):Ⅰ.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体Ⅱ.将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6gⅢ.在Ⅱ的滤液中滴加BaCl2溶液,无明显现象n下列说法错误的是( )A.实验Ⅲ能确定一定不存在SOB.K+一定存在,且c(K+)≤1.3mol·L-1C.实验Ⅰ能确定一定不存在的离子是Ag+、Mg2+、Ba2+D.实验Ⅰ中生成沉淀的离子方程式为SiO+2H+===H2SiO3↓5.已知某溶液中可能含有NO、Cl-、SO、CO、NH、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;②将沉淀过滤、洗涤、灼烧,得到1.6g固体;③向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。请回答下列问题:(1)结合①和②,判断原溶液中肯定含有的离子是_____________________________________,可以排除的离子是________。(2)由③推知原溶液中一定有________离子,其物质的量为________mol。(3)综合(1)、(2)及题干信息,结合溶液中电荷守恒知识,还可以排除的离子是________。该学习小组最终得出结论:该溶液由________种阳离子(填数字,下同)和_________种阴离子组成。题型三 “图文结合”型离子检验与推断6.(2019·南宁模拟)在某溶液中滴加氢氧化钠溶液,产生沉淀的物质的量(n)与氢氧化钠溶液体积(V)的关系如图所示。该溶液中可能含有的离子组是( )A.Na+、Mg2+、Al3+、NO、Cl-B.Cu2+、H+、Fe3+、Mg2+、SOC.NH、H+、Al3+、HCO、NOD.NH、H+、Al3+、SO、Br-7.(2019·北京质检)已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:阳离子K+、NH、Mg2+、Ba2+、Fe3+阴离子Cl-、Br-、CO、HCO、SOn现进行如下实验操作(每次实验所加试剂均过量):(1)由气体B可确定待测液中含有的离子是________。(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是__________,据此可以排除的离子是____________。(3)由白色沉淀B可确定待测液中含有的离子是______________________________________。(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是______________________。(5)综合分析,待测液中K+的最小浓度为____________________________________________。n答案精析1.A [由②知溶液中无I-、S2-,根据溶液电中性原则,则一定有SO,故无Ba2+;由①知溶液呈弱酸性,推知溶液中含NH,还需检验的是Na+。]2.C [滴加KSCN溶液后显红色,说明原溶液中一定含有Fe3+,Fe3+与CO能发生相互促进的水解反应而不能大量共存,Fe3+与I-能发生氧化还原反应而不能大量共存,故原溶液中一定不含CO、I-;根据溶液呈电中性可知,原溶液中一定含SO,而K+需要经过焰色反应才能确定其是否存在,A、B、D项正确,C项错误。]3.A [①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,2Na2O2+2H2O===4NaOH+O2↑,产生无色无味的气体,说明无NH,再加入足量的NaOH溶液后白色沉淀全部溶解,说明无Mg2+,有Al3+,无HCO;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生,说明无SO,溶液中只有Cl-一种阴离子,A项正确;应无Mg2+和NH,K+不能确定,B、C两项错误;Al3+水解呈酸性,D项错误。]4.B5.(1)NH、Fe3+ CO (2)SO 0.02(3)Al3+和K+ 2 3解析 ①取该溶液100mL,加入过量NaOH溶液,加热,得到0.02molNH3,则100mL溶液中含0.02molNH;同时产生红褐色Fe(OH)3沉淀,则原溶液中一定含有Fe3+,CO与Fe3+不能大量共存,则溶液中一定不含有CO。②将沉淀过滤、洗涤、灼烧,得到1.6gFe2O3固体,则原溶液中Fe3+的物质的量为0.02mol。③向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀,该沉淀为BaSO4且物质的量为0.02mol,则原溶液中含SO0.02mol;溶液中所含阴离子的物质的量相等,根据电荷守恒知,溶液中还含有0.02molCl-和0.02molNO,溶液中一定不含Al3+和K+。6.D [从图像看,开始滴加氢氧化钠溶液,不产生沉淀,说明溶液中含有H+;图像中有一段平台,说明溶液中含有NH;最终沉淀完全溶解,说明溶液中含有Al3+,不含Fe3+、Mg2+、Cu2+等离子,A、B项不符合题意;Al3+、HCO不能大量共存,且H+与HCO也不能大量共存,C项不符合题意。]7.(1)NH(2)CO、SO Mg2+、Ba2+、Fe3+(3)HCO(4)向溶液B中通入氯气,溶液呈浅黄绿色(或向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀)(5)0.1mol·L-1解析 待测液与BaCl2溶液反应生成沉淀A,沉淀A与稀硝酸反应生成白色沉淀D和无色气体D,无色气体D与石灰水反应生成白色沉淀E,则待测液中一定含有SO和COn,结合离子共存的条件可知待测液中一定不存在Mg2+、Ba2+、Fe3+;溶液A与NaOH反应生成的气体B为NH3,同时还生成了白色沉淀B,则待测液中一定含有NH、HCO;根据向溶液B中通入氯气,溶液呈浅黄绿色和向溶液B中滴加硝酸酸化的硝酸银溶液,出现白色沉淀可知,待测液中一定不存在Br-;由于实验过程中加入了BaCl2溶液,因此由白色沉淀C无法确定待测液中是否含有Cl-。结合题中数据可知待测液中n(NH)=0.1mol,n(HCO)=n(BaCO3)沉淀B==0.1mol,n(CO)=n(CaCO3)沉淀E==0.1mol,n(SO)=n(BaSO4)沉淀D==0.05mol,n(Na+)+n(NH)=0.2mol+0.1mol=0.3mol,2n(CO)+2n(SO)+n(HCO)=0.4mol,根据电荷守恒知待测液中一定含有K+。若待测液中不含Cl-,则n(K+)=0.1mol;若待测液中含有Cl-,则n(K+)>0.1mol,所以c(K+)≥0.1mol·L-1。