- 801.52 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
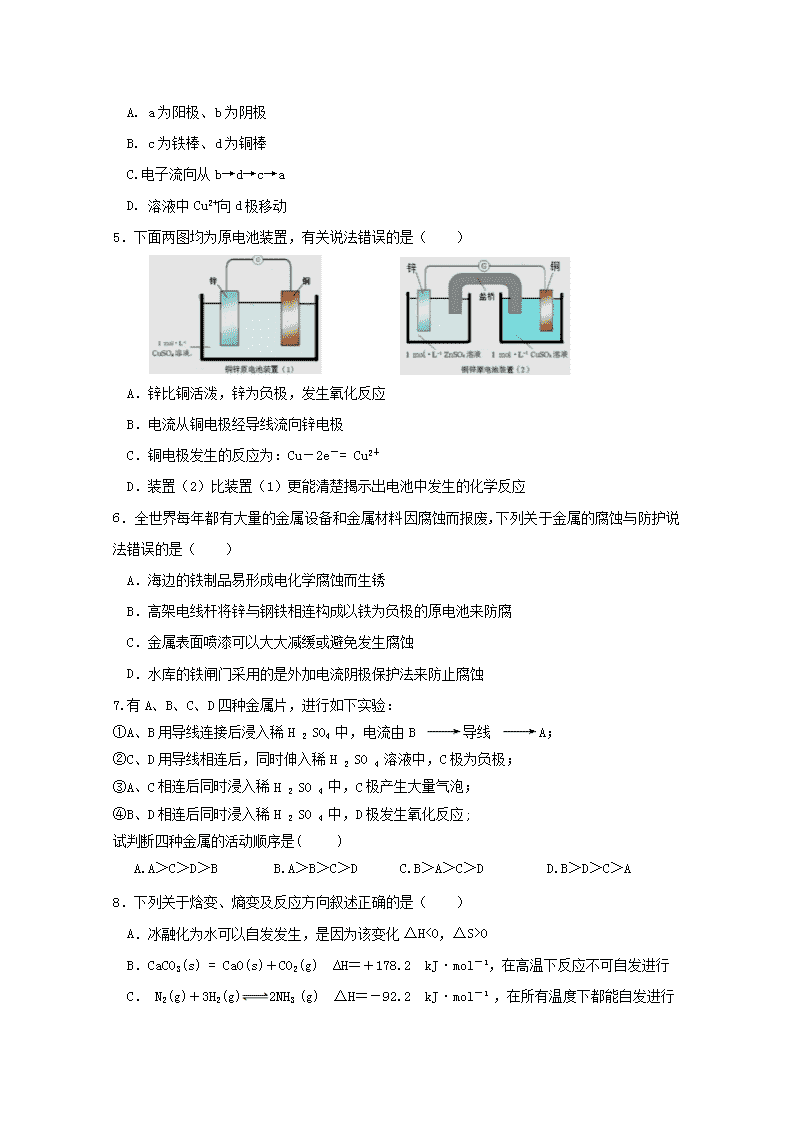
宁德市高中“同心顺”联盟2018-2019学年第一学期期中考试高二化学试题(考试时间:90分钟;满分:100分)温馨提示:1.本学科试卷分试题卷和答题卡两部分。试题卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)(共7页20题),全部答案必须按要求填在答题卡的相应答题栏内,否则不能得分。2.相对原子质量:H-1C-12Fe-56Cu-64Ag-108第I卷选择题(共48分)本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。1.各种形式的能量转换为生活提供便利,下列选项主要依靠化学能转化为热能的是()捏破内袋瞬间降温A.一次性速冷冰袋B.自热饭速食米饭C.新能源汽车D.麒麟970芯片2.下列物质间的反应,其能量变化符合如图所示的是( )A.碳酸钙高温分解B.氢氧化钠与盐酸的反应C.Ba(OH)2•8H2O晶体和NH4Cl晶体混合D.灼热的碳与二氧化碳反应3.已知在常温常压下,1mol氢气完全燃烧生成液态水放出akJ热量,下列热化学方程式正确的是()A.2H2+O2=2H2OΔH(298K)=-akJ·mol—1B.2H2(g)+O2(g)=2H2O(l)ΔH(298K)=+2akJC.H2(g)+O2(g)=H2O(l)ΔH(298K)=-akJ·mol—1D.H2(g)+O2(g)=H2O(g)ΔH(298K)=-akJ·mol—14.某化学兴趣小组利用右图装置在铁棒表面镀上一层铜,下列有关的判断正确的是()nA.a为阳极、b为阴极B.c为铁棒、d为铜棒C.电子流向从b→d→c→aD.溶液中Cu2+向d极移动5.下面两图均为原电池装置,有关说法错误的是()A.锌比铜活泼,锌为负极,发生氧化反应B.电流从铜电极经导线流向锌电极C.铜电极发生的反应为:Cu-2e-=Cu2+D.装置(2)比装置(1)更能清楚揭示出电池中发生的化学反应6.全世界每年都有大量的金属设备和金属材料因腐蚀而报废,下列关于金属的腐蚀与防护说法错误的是()A.海边的铁制品易形成电化学腐蚀而生锈B.高架电线杆将锌与钢铁相连构成以铁为负极的原电池来防腐C.金属表面喷漆可以大大减缓或避免发生腐蚀D.水库的铁闸门采用的是外加电流阴极保护法来防止腐蚀7.有A、B、C、D四种金属片,进行如下实验:①A、B用导线连接后浸入稀H2SO4中,电流由B导线A;②C、D用导线相连后,同时伸入稀H2SO4溶液中,C极为负极;③A、C相连后同时浸入稀H2SO4中,C极产生大量气泡;④B、D相连后同时浸入稀H2SO4中,D极发生氧化反应;试判断四种金属的活动顺序是()A.A>C>D>B B.A>B>C>D C.B>A>C>D D.B>D>C>A8.下列关于焓变、熵变及反应方向叙述正确的是()A.冰融化为水可以自发发生,是因为该变化ΔH<0,ΔS>0B.CaCO3(s)=CaO(s)+CO2(g) ∆H=+178.2 kJ·mol-1,在高温下反应不可自发进行C.N2(g)+3H2(g)2NH3(g)ΔH=-92.2 kJ·mol-1,在所有温度下都能自发进行nD.钠与水的反应是熵增的放热反应,该反应能自发进行9.下列化学平衡常数表达式正确的是()A.N2(g)+3H2(g)2NH3(g)B.H2(g)+I2(g)2HI(g)C.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)D.FeO(s)+CO(g)Fe(s)+CO2(g)10.已知反应H2(g)+CO2(g)H2O(g)+CO(g)在1200℃时的平衡常数K为2.25。在该温度下,往体积为1L的密闭容器中注入1molH2和2mol CO2,反应开始一段时间后,测得CO的物质的量为0.5mol时,上述反应进行的方向为( )A.正向进行B.逆向进行C.达到平衡D.无法判断11.某些自来水厂用液氯消毒自来水,为了安全一般在1L水中仅通入约0.005g氯气,为了延长杀菌消毒时间还加入少量液氨,NH2Cl较稳定可较长时间存在,其中存在以下两个平衡:①Cl2+H2OHCl+HClOΔH<0;②NH3+HClOH2O+NH2ClΔH<0。下列说法正确的是()A.温度越高越有利于①的平衡向右移动,生成更多的HClOB.可以研制出一种催化剂促使①的平衡向右移动C.当HClO浓度较高时,有利于②的平衡向右移动D.消毒自来水时,可以通入超量的Cl2来提高HClO的浓度12.在恒温恒容密闭容器内进行反应:2SO2(g)+O2(g)2SO3(g),K为该温度下的化学平衡常数,经过一段时间后,下列能判断该可逆反应达到化学平衡状态的一组是()①每生成1molSO3的同时消耗1molSO2②通过测得的三种物质浓度计算出的浓度商Q与K相等③容器内各物质浓度不再发生变化④容器中混合气体的密度不再发生变化⑤测得n(SO2):n(O2):n(SO3)=2:1:2nA.①②B.②③C.③④D.④⑤13.25℃时,在密闭容器中建立下列化学平衡:X(g)+3Y(g)2Z(g)ΔH<0,X、Y、Z的初始浓度和平衡浓度如下表:物质XYZ初始浓度/(mol/L)0.10.20平衡浓度/(mol/L)0.050.050.1下列说法正确的是( )A.反应达到平衡时,Y的转化率为50%B.升髙温度,有利于平衡向正向移动C.增大X的浓度,使平衡向正向移动,X、Y的转化率均增大D.增大压强,使平衡向生成Z的方向移动,该反应平衡常数不变14.已知某可逆反应mA(g)+nB(g)qC(g) ΔH在密闭容器中进温度T和压强P下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中错误的是( )A.P1T2C.m+n”、“<”或“=”)573K。T/K573T1K/(mol·L-1)-22.45×1051.88×103(2)①NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH=-905kJ·mol-1。不同温度下NO的产率如图所示:n温度高于900℃时,NO产率下降的原因是___________________________________________。②氨气若在纯氧中燃烧,则发生反应为4NH3+3O22N2+6H2O,科学家利用此原理,设计成氨气氧气燃料电池,则通入氧气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生的电极反应式为__________________________________。II.(3)肼(N2H4)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。写出该反应的化学方程式:_________________________________________。(4)已知:①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJ•mol﹣1②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ•mol﹣1写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:____________________________________________________19.(12分)I.目前工业上可利用CO或CO2来生产燃料甲醇,已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:化学反应平衡常数温度℃500800①2H2(g)+CO(g)CH3OH(g)K12.50.15②H2(g)+CO2(g)H2O(g)+CO(g)K21.02.50③3H2(g)+CO2(g)CH3OH(g)+H2O(g)K3ab请回答下列问题:(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。(2)要使反应③在一定条件下建立的平衡正向移动,可采取的措施是_____(填字母)。A.升高温度 B.增大反应容器的容积C.使用合适的催化剂D.从平衡体系中及时分离出CH3OH(3)在一定温度下的恒容密闭容器中,不能说明反应③达到平衡的标志是()A.容器内各组分的浓度不再变化B.容器内混合气体压强不再变化C.单位时间内消耗3molH2,同时生成1molCH3OHD.容器内混合气体的平均相对分子质量不再变化II.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:n2CO(g)+SO2(g)2CO2(g)+S(l)△H=-270kJ•mol-1(4)T℃时,2L密闭容器中投入2molCO、1molSO2进行上述反应,达到平衡时,CO的物质的量为1mol,T℃时该反应的平衡常数K为_________。(5)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图所示。(图中曲线表示不同温度下,反应经过相同时间且未达到平衡时SO2的转化率)其他条件相同、催化剂不同时,SO2的平衡转化率___________(填“相同”或“不相同”)。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是。20.(14分)I.(1)某兴趣小组的同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。①该电解槽的阴极反应式为_______________________________。②通电开始后,阳极附近溶液pH会___________(填“变大”、“变小”或“不变”),请简述原因:_________________________________________________________。II.该小组同学用如图所示装置研究有关电化学的问题。n(2)写出通入CH3OH的电极反应式是___________________________________。(3)当乙池中B(Ag)极的质量增加1.08g时,乙池的氢离子浓度是(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.32g某金属,则丙中的某盐溶液可能是(填序号)A.MgSO4B.CuSO4C.NaCl(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池能量转化效率高,其次是_______________________________。n宁德市高中“同心顺”联盟2017-2018学年第一学期期中考试高二化学试题答案题号12345678答案BBCDCBAD题号910111213141516答案BACBDDAA17.(12分,每空2分)(1)保温环形玻璃搅拌器(2)H++OH-=H2O(3)盐酸稀释放热对中和反应反应热测定影响不大(或影响较小)(4)a>b>cB18.(14分)(1)>(2分)(2)①温度高于900℃时,平衡向左移动(2分)②正极(2分) O2+2H2O+4e-=4OH-(2分)(3)2NH3+NaClO===NaCl+N2H4+H2O(3分)(配平错误扣给分)(4)2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873kJ•mol﹣1(3分)(方程式错误不给分,方程式正确但△H计算或单位错误扣一分)19.(12分,每空2分)(1)K1·K2(2)D(3)C(4)4(mol•L﹣1)﹣1(计算或单位错误不给分,计算对单位没写给分)(5)相同Fe2O3在较低温度可获得较高SO2的转化率20.(14分,每空2分)(1)①2H++2e-===H2↑或2H2O+2e-===H2↑+2OH-②变小OH-在阳极附近放电,H+浓度增大(2)CH3OH+8OH--6e-===CO32-+6H2On(3)0.04mol•L﹣1(单位没写给1分)B(4)产物对环境无污染