- 582.76 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
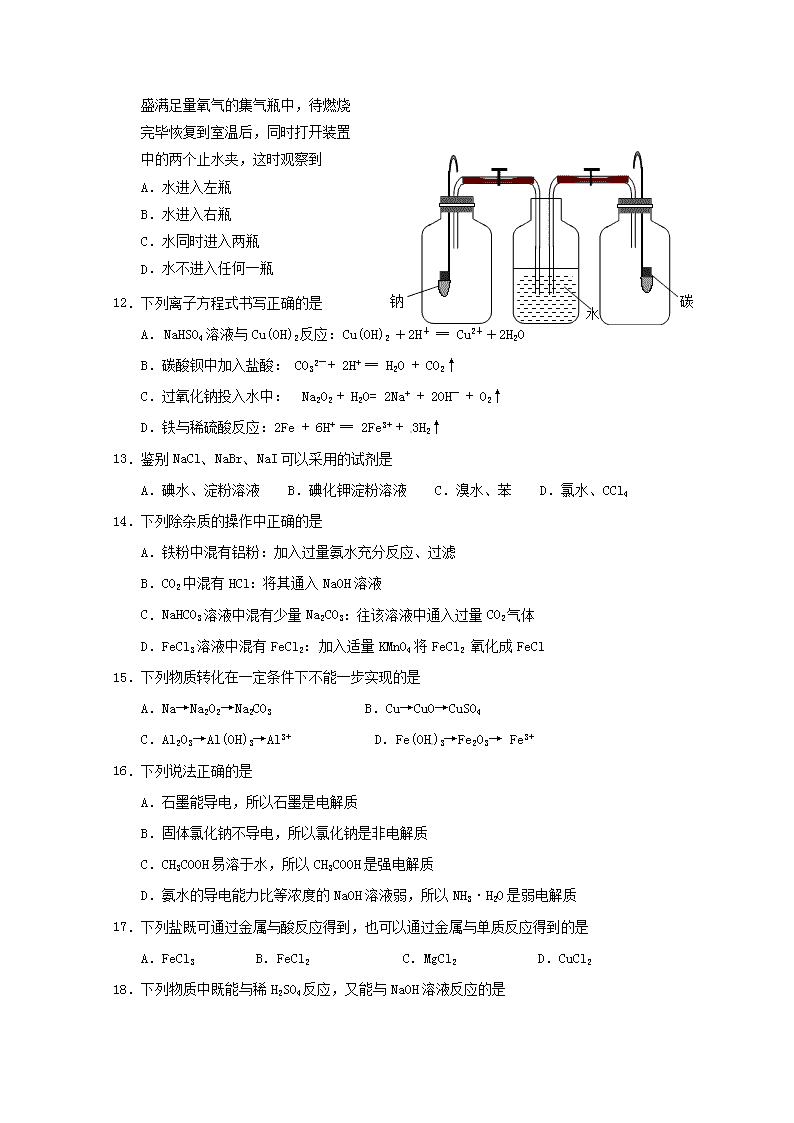
福建省永春县第一中学2018-2019学年高一化学下学期期初考试试题试卷满分:100分考试时间:90分钟可能用到的原子量:H:1 C:12 O:16 S:32 Cl:35.5Na:23Mg:24N:14Ba:137Fe:56第I卷(选择题,共44分)一、选择题(每小题只有一个选项符合题意,本题包括21小题,共42分)1.当光束通过稀豆浆时,可产生丁达尔效应,表明稀豆浆属于A.纯净物B.溶液C.胶体D.浊液2.设NA表示阿伏加德罗常数,下列叙述中正确的是A.常温常压下,11.2L氧气所含的分子数为NAB.1.8g的NH4+中含有的电子数为NAC.常温常压下,48gO3含有的氧原子数为NAD.24g金属镁变为镁离子时失去的电子数为NA3.下列表格中各项分类都正确的一组是:类别选项纯净物混合物电解质非电解质A生理盐水明矾液态KNO3蔗糖BCaO海水铜乙醇C胆矾铝合金AgClCO2D氢氧化钠空气Na2SO4溶液食醋4.下列图示的实验或操作正确的是A.转移溶液B.将海带灼烧成灰nC.金属钠的保存D.用酿制的米酒获取酒精5.下列化学用语正确的是A.互为同位素:14C和14NB.硫酸的电离方程式:H2SO4=H2++SO42 -C.S2-的结构示意图:D.明矾的化学式:KAl(SO4)2•12H2O6.对下列物质性质或用途的描述不符合事实的是A.氯水用于漂白表现了HClO的强氧化性B.将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出C.过氧化钠可用作呼吸面具中的供氧剂D.铝可用于冶炼某些熔点较高的金属7.在稀溶液中能共存,加入NaOH溶液后有沉淀析出,加入盐酸后有气体逸出的一组离子是A.Na+、SO42-、Cu2+、Cl-B.Na+、Ca2+、Cl-、HCO3-C.K+、Na+、NO3-、CO32-D.Ca2+、K+、SO42-、CO32-8.amolO2气体和amolO3气体相比较,下列叙述一定正确的是A.体积相同 B.原子数相等 C.分子数相等D.质量相等9.金属钠跟下列溶液反应时,既有气体放出,最终一定有白色沉淀生成的是A.KClB.Ca(HCO3)2溶液C.FeCl3溶液D.AlCl3溶液10.最近网络流行一首“我们不一样”,在化学世界里也存在许多的“不一样”,下列有关说法一样的是A.镁和铝分别在空气中的燃烧产物的种类B.钠在常温下或在空气中加热的产物C.等物质的量的Na2CO3和NaHCO3溶液分别与足量的稀盐酸反应,产生二氧化碳的量D.常温下,等物质的量浓度的Na2CO3和NaHCO3溶液的pH11.将钠和碳分别置于如图所示的两个n盛满足量氧气的集气瓶中,待燃烧完毕恢复到室温后,同时打开装置中的两个止水夹,这时观察到A.水进入左瓶 B.水进入右瓶C.水同时进入两瓶D.水不进入任何一瓶12.下列离子方程式书写正确的是A.NaHSO4溶液与Cu(OH)2反应:Cu(OH)2+2H+═Cu2++2H2OB.碳酸钡中加入盐酸:CO32-+2H+═H2O+CO2↑C.过氧化钠投入水中: Na2O2+H2O=2Na++2OH-+O2↑D.铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑13.鉴别NaCl、NaBr、NaI可以采用的试剂是A.碘水、淀粉溶液B.碘化钾淀粉溶液C.溴水、苯D.氯水、CCl414.下列除杂质的操作中正确的是A.铁粉中混有铝粉:加入过量氨水充分反应、过滤B.CO2中混有HCl:将其通入NaOH溶液C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体D.FeCl3溶液中混有FeCl2:加入适量KMnO4将FeCl2氧化成FeCl15.下列物质转化在一定条件下不能一步实现的是A.Na→Na2O2→Na2CO3B.Cu→CuO→CuSO4C.Al2O3→Al(OH)3→Al3+D.Fe(OH)3→Fe2O3→Fe3+16.下列说法正确的是A.石墨能导电,所以石墨是电解质B.固体氯化钠不导电,所以氯化钠是非电解质C.CH3COOH易溶于水,所以CH3COOH是强电解质D.氨水的导电能力比等浓度的NaOH溶液弱,所以NH3·H2O是弱电解质17.下列盐既可通过金属与酸反应得到,也可以通过金属与单质反应得到的是A.FeCl3B.FeCl2C.MgCl2D.CuCl218.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是n①NaHCO3②Al2O3③Al(OH)3④Al⑤Na2CO3A.①②③④B.③④C.①③④D.全部19.工业上冶炼锡的第一步反应原理为2SnO2+3C2Sn+aM↑+CO2↑,则下列说法中错误的是A.a的值为2B.反应中SnO2被还原C.每生成1molM转移电子8molD.反应后有两种氧化产物20.下列实验方法正确的是A.用酒精从NaCl与Br2的混合溶液中提取Br2B.用NaOH溶液鉴别AlCl3溶液、Mg(NO3)2溶液和K2SO4溶液C.用Ba(NO3)2溶液除去NaCl溶液中的SO42-D.用淀粉溶液检验溶液中是否存在碘离子21.某溶液中,含有H+、Mg2+、Al3+三种阳离子,加入NaOH溶液的体积(V)和生成沉淀的质量(m)之间的关系如下图所示,其中正确的是第Ⅱ卷(非选择题共58分)二、填空题(本题共有5小题,共58分)22.(6分)中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出).单质A常作为食品包装材料,甲是两性氧化物.根据图示转化关系回答:(1)写出反应①的离子方程式: .(2)实验室完成单质A与Fe2O3反应实验,需要的试剂还有 .a.KCl b.KClO3 c.MnO2 d.Mgn利用该反应的原理,工业上可用于 .23.(8分)欲用密度为1.18g/cm3(质量分数36.5%)的浓盐酸配制250mL1mol/L盐酸,回答下列各问:(1)所需浓盐酸体积约为__________mL(填整数)。(2)所需仪器为量筒、烧杯、玻璃棒、胶头滴管还缺少的玻璃仪器是。(3)若定容时俯视,所配溶液的物质的量浓度比要求的值(填“偏高”或“偏低”)。(4)若定容后再摇匀静置,发现凹液面低于刻度线。此时应该(填标号)_________。A.直接转移到试剂瓶中B.加水重新定容后贮存于容量瓶中C.重新定容后再转移到试剂瓶中24.(8分)向200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol∕L的盐酸,所得气体的体积与所加盐酸的体积关系如下图所示:(1)OA段、AB段发生反应的离子方程式:、(2)B点时,反应所得溶液中溶质的物质的量浓度是。(3)原NaOH溶液的物质的量浓度是。 25.(16分)综合利用海水可以制备氯化铵、纯碱、金属镁等物质,其流程如下图所示:nI.(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸②氯化钡溶液③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为________。A.②③④①B.③④②①C.④③②①D.③②④①(2)写出反应②的离子方程式(3)X溶液中的主要阳离子是Na+和Ⅱ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。(4)若用来提取Mg,根据上述提取Mg的流程,没有涉及的反应类型是________。A.分解反应B.化合反应C.置换反应D.复分解反应(5)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:甲:母液先提取Mg,后提取Br2乙:母液先提取Br2,后提取Mg请你判断哪个更合适并说明理由:_________________________。Ⅲ.NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。(6)上述反应中氧化剂是________。(7)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾 淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。(8)请配平以下化学方程式:____Al+____NaNO3+____NaOH=____NaAlO2+____N2↑+___H2O若反应过程中转移5mol电子,则生成标准状况下N2的体积为_________L。26.(20分)如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。n(1)已知该实验反应的反应方程式为:Fe+H2OFe3O4+H2(请配平)。(2)A中圆底烧瓶底部放置了几片碎瓷片,其作用是。(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。①该同学应该先点燃 (填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中 (填“甲”“乙”或“丙”)装置。 ②称取5.6g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.56L,则铁粉的转化率为 。()(4)甲同学对实验后的黑色固体产物X含有哪些物质进行了如下实验:实验步骤实验操作实验现象Ⅰ取少量黑色固体产物X(假定成分分布均匀)放入试管中,加入盐酸,微热。黑色粉末逐渐溶解,有少量气泡产生。Ⅱ取实验Ⅰ反应后的溶液少许,滴加几滴KSCN溶液,振荡。溶液没有出现血红色。Ⅲ取实验Ⅰ反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡。高锰酸钾溶液褪色。根据以上实验事实,能确定固体X中存在的物质是,但不能确定X的成分,原因是。(5)乙同学为了探究实验后的固体产物是否存在Fe3O4设计下列实验方案:①取固体样品m1g,溶于足量的稀盐酸;②向①反应后的溶液中加入足量新制氯水和氨水,充分反应后,过滤、洗涤、干燥;③将②中所得固体进行灼烧,得到红棕色固体m2g。写出Fe3O4与盐酸反应的化学方程式,新制氯水的作用是;m1与m2的比值在范围内时,才能确定固体样品中一定存在Fe3O4。永春一中高一年期初考试化学科参考答案及评分标准n一、选择题(每小题2分,共42分)1-5:CBCCD6-10:BBCBC11-15:AADCC16-21:DCACBB二、填空题(本题共有5小题,共58分)22.(每空2分,共6分)(1)2Al+2OH-+2H2O=2AlO2-+3H2↑;(2)bd;焊接钢轨等;23.(每空2分,共8分)(1)21(2)250mL容量瓶(3)偏高(4)A24.(8分)(1)CO32-+H+=HCO3- HCO3–+H+=CO2↑+H2O(2)1.2mol·L-1 (3)3mol·L-125.(16分)(1)AD(2分)(2)Mg(OH)2+2H+=Mg2++2H2O(2分)(3)NH4+(1分)(4)BC(2分)(5)乙。若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2(其他合理解释也可)(2分)(6)NaNO2(1分)(7)②⑤(2分)(8)10641032(2分)11.2(2分)26.(20分)(1)3、4、1、4(2分)(2)防止暴沸(2分)(3)①A、甲(各2分)②18.75%(2分)(4)Fe(2分)不能确定是否含有Fe3O4或FeO,如果混合物中存在Fe3O4,溶于盐酸生成的Fe3+与Fe反应会生成了Fe2+;且溶液中的Fe2+也有可能是FeO与盐酸反应的产物(2分)(5)Fe3O4+8HCl=2FeCl3+FeCl2+4H2O(2分)将Fe2+氧化成Fe3+(2分)0.9<≤0.97(2分)