- 404.96 KB
- 2022-03-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
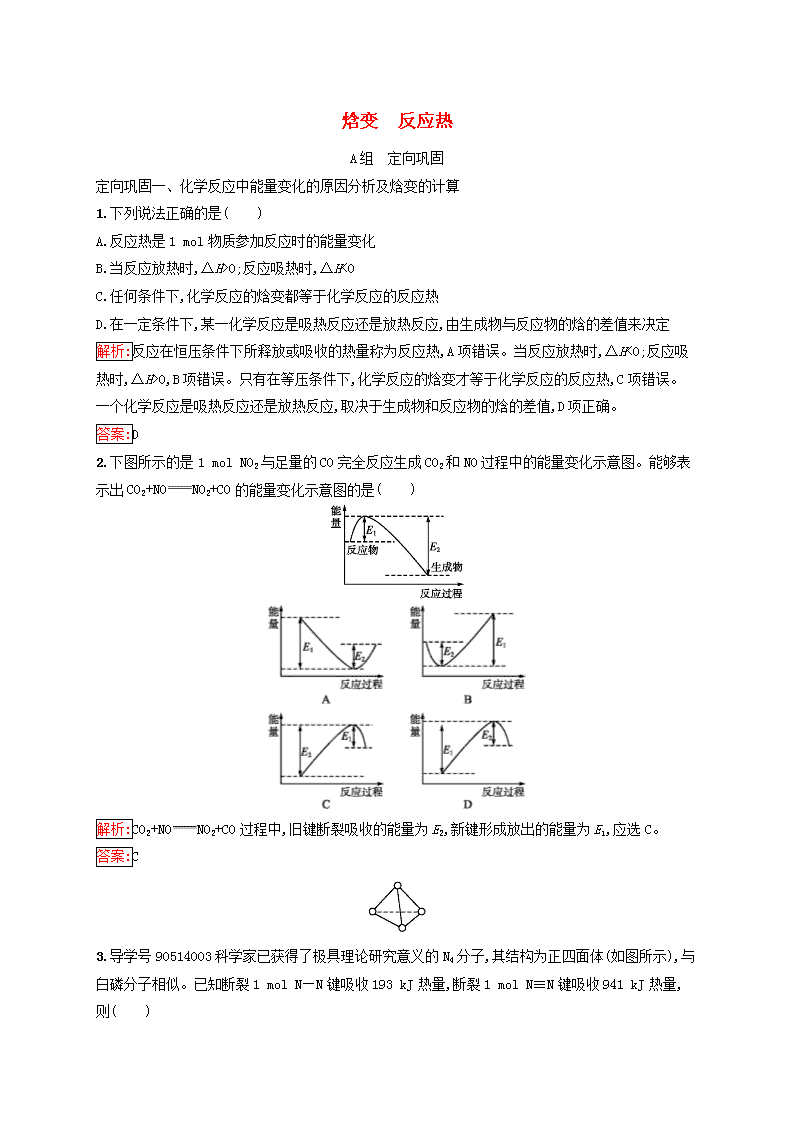
焓变 反应热A组 定向巩固定向巩固一、化学反应中能量变化的原因分析及焓变的计算1.下列说法正确的是( )A.反应热是1mol物质参加反应时的能量变化B.当反应放热时,ΔH>0;反应吸热时,ΔH<0C.任何条件下,化学反应的焓变都等于化学反应的反应热D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓的差值来决定解析:反应在恒压条件下所释放或吸收的热量称为反应热,A项错误。当反应放热时,ΔH<0;反应吸热时,ΔH>0,B项错误。只有在等压条件下,化学反应的焓变才等于化学反应的反应热,C项错误。一个化学反应是吸热反应还是放热反应,取决于生成物和反应物的焓的差值,D项正确。答案:D2.下图所示的是1molNO2与足量的CO完全反应生成CO2和NO过程中的能量变化示意图。能够表示出CO2+NONO2+CO的能量变化示意图的是( )解析:CO2+NONO2+CO过程中,旧键断裂吸收的能量为E2,新键形成放出的能量为E1,应选C。答案:C3.导学号90514003科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则( )nA.4molN原子形成1molN4气体分子,放出772kJ热量B.1molN4气体转化为N2时要吸收748kJ能量C.仅从能量角度分析,N4的化学性质比N2更稳定D.1molN4气体转化为N2时要放出724kJ能量解析:4molN原子形成1molN4气体分子,由于1molN4分子中有6molN—N键,放出193kJ×6=1158kJ热量;1molN4气体转化为2molN2时,断裂6molN—N键,吸收的能量=193kJ×6=1158kJ,形成2molN≡N键放出的能量=941kJ×2=1882kJ,该过程放出的能量=1882kJ-1158kJ=724kJ。答案:D4.在一定条件下,A和B反应可生成C和D,其能量变化如下:A+B总能量为E1kJ(反应前)C+D总能量为E2kJ(反应后)(1)下列关于反应A+BC+D的说法正确的是 。 A.反应前后原子的种类和数目一定不变B.该反应若有热量变化,则一定是氧化还原反应C.若该反应为放热反应,则不需要加热就一定能进行D.反应物的总质量与生成物的总质量一定相等,且该反应遵循能量守恒(2)若E12b时,反应放热 kJ;当a<2b时,反应放热 kJ。 n解析:(1)反应可以改成:2H2S+SO238S8+2H2O。根据公式:ΔH=反应物的键能总和-生成物的键能总和=4×364kJ·mol-1+2×522kJ·mol-1-3×266kJ·mol-1-4×463kJ·mol-1=-150kJ·mol-1。(2)当a>2b时,H2S过量应依据SO2的物质的量计算,当a<2b时,SO2过量应依据H2S的物质的量计算。答案:(1)-150 (2)150b22.4 150a44.86.已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答问题。该反应是 (填“吸热”或“放热”)反应,该反应的ΔH= kJ·mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量 (填“>”“<”或“=”)1mol气体C和1mol气体D具有的总能量。 解析:从图像中看出反应物的能量小,产物的能量大,该反应一定为吸热反应。答案:吸热 E1-E2 <