- 267.29 KB
- 2022-07-20 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
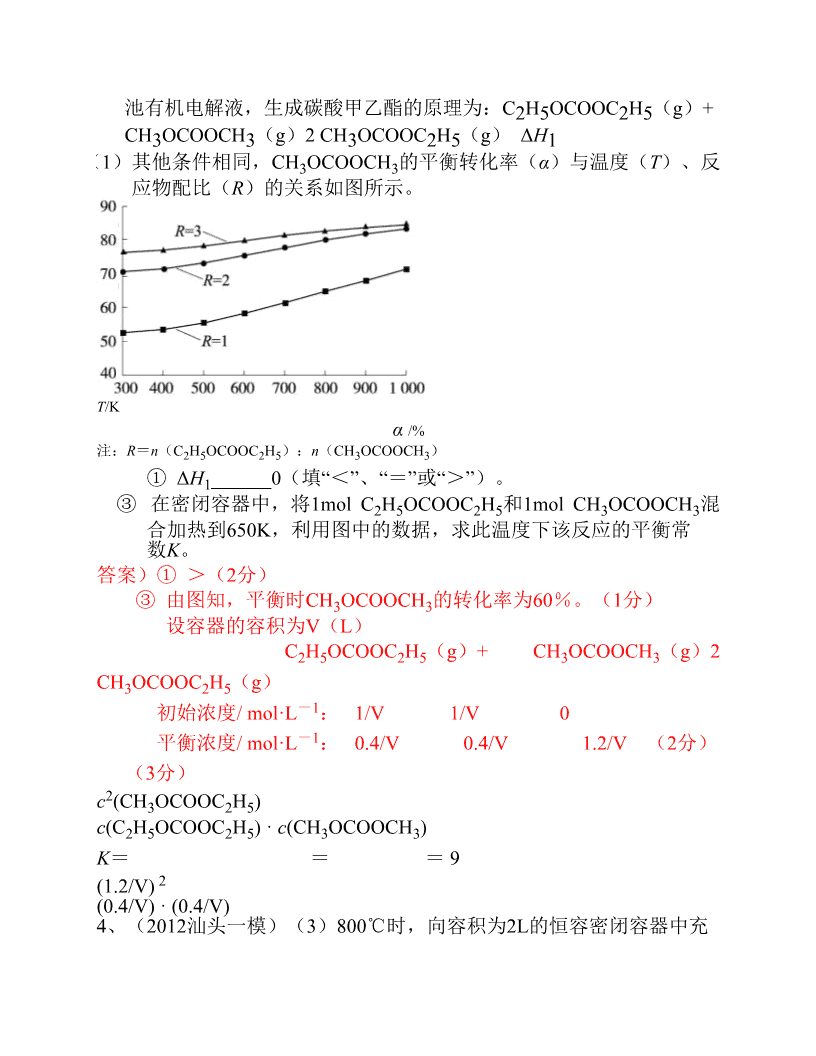
广东高考专题高考中的计算题(2010广东高考)(3)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l)[B(OH)]-(aq)+H+(aq),已知0.70mol·L-1HBO溶液中,上述反应433于298K达到平衡时,c(H+)=2.0×10-5mol·L-1,c(HBO)≈c平衡平衡33起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。【答案】(3)H3BO3(aq)+H2O(l)[B(OH)]-(aq)+H+(aq)4起始时各物质浓度/mol·L-1:0.7000平衡时各物质浓度/mol·L-10.702.0×10-52.0×10-5K===5.7×10-10mol·L-1(2011年广东高考)(3)将试剂初步提纯后,准确测定其中Ba(OH)·8HO的含量。实验如下:①配制250ml约0.1mol•L-221Ba(OH)·8HO溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,22,将溶液转入,洗涤,定容,摇匀。②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。③计算Ba(OH)2·8H2O的质量分数=(只列出算式,不做运算)(4)室温下,(填“能”或“不能”)配制1.0mol•L-1Ba(OH)溶液2答案(3)①溶解、过滤;250ml的容量瓶中。②0.1980思路:0.025x0.1x2=C’x0.05------(盐酸体积最多不能多于50ml)得C’=0.1mol•L-1所以应该是选大于0.1mol•L-1而且接近的③25xCx2=0.1980xV得C=(0.1980/50)V,Ba(OH)2·8H2O的质量分数=x0.1980Vx315x100%/50w。(4)不能\n一、反应速率、平衡常数、转化率的有关计算1、(2012肇庆一模改编)31.(15分)“硫碘”循环分解水制氢主要涉及下列反应:Ⅱ.2HIH2+I2;(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。0~2min内的平均反应速率v(HI)=________。该温度下,Ⅱ的逆反应H2(g)+I2(g)2HI(g)的平衡常数K=________。31.分析通过图形或表格直接或间接告诉K(或转化率)来求转化率(或K)(2)(6分)0.1mol/(L·min)(3分,没单位或单位错0分)64(3分)2、在aMPa和一定温度下,将6molH2和2molCO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(写出计算过程,计算结果保留2位有效数字。)【通过有关数据,通过一个关系量等式(告诉产物的体积分数、物质的量变化等等),计算出转化率,甚至可以算出平衡常数。】解:设平衡时CO2的转化率为x2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)c(开始)mol/L1300c(转化)mol/Lx3xx/23x/2c(平衡)mol/L1-x3-3xx/23x/2(1分)0.5x/(1-x+3-3x+0.5x+1.5x)×100%=16.7%(2分)x=0.80(2分,有效数字不正确扣1分)CO2的转化率为80%3、(2012广一模)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电\n池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+CH3OCOOCH3(g)2CH3OCOOC2H5(g)ΔH1(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。T/Kα/%注:R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)①ΔH1______0(填“<”、“=”或“>”)。③在密闭容器中,将1molC2H5OCOOC2H5和1molCH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K。答案)①>(2分)③由图知,平衡时CH3OCOOCH3的转化率为60%。(1分)设容器的容积为V(L)C2H5OCOOC2H5(g)+CH3OCOOCH3(g)2CH3OCOOC2H5(g)初始浓度/mol·L-1:1/V1/V0平衡浓度/mol·L-1:0.4/V0.4/V1.2/V(2分)(3分)c2(CHOCOOCH)325c(C2H5OCOOC2H5)·c(CH3OCOOCH3)K===9(1.2/V)2(0.4/V)·(0.4/V)4、(2012汕头一模)(3)800℃时,向容积为2L的恒容密闭容器中充\n入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表:反应时0246间/minn(CO)/mol1.200.900.80n(H2O)/0.600.20mol①反应在2min内的平均速率为v(H2O)=________________;②800℃时,K2的值为_______________;(3)①0.075mol·L-1·min-1(2分)②1(2分)二、沉淀溶解平衡有关计算题1、在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时()。(A)c(Ba2+)=c(SO2-);(B)c(Ba2+)=c(SO2-)=[K(BaSO)]1/2;444(C)c(Ba2+)c(SO2-),[c(Ba2+)]·[c(SO2-)]=K(BaSO);444(D)c(Ba2+)c(SO2-),[c(Ba2+)]·[c(SO2-)]K(BaSO)。4442、在100ml0.01mol/LKCl溶液中,加入1ml0.01mol/LAgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10)()A.有AgCl沉淀析出B.无AgCl沉淀C.有沉淀,但不是AgClD.无法确定3、为了除去ZnSO溶液中的Fe2+,在pH=4.00时加入KMnO,将Fe2+氧化44为Fe3+,并生成Fe(OH)沉淀而除去,MnO-则被还原为MnO沉淀,过滤342后即可得纯ZnSO溶液。试通过计算证明pH=4.0时,Fe3+已沉淀完全,4而Zn2+则不生成Zn(OH)沉淀。2(K(Fe(OH))=4.010-38,K(Zn(OH))=1.210-17)【当剩余离子即平衡离子浓32度≤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。】\n4、将4×10-3molL-1的AgNO溶液与4×10-3molL-1的NaCl溶液等体积混3合能否有沉淀析出?Ksp(AgCl)=1.8×10-10mol2L-25、在1L含1.0×10-3molL-1的SO2-溶液中,注入0.01molBaCl溶液(假42设溶液体积不变)能否有效除去SO2-?已知:Ksp(BaSO)=1.1×10-1044mol2L-2(当剩余离子即平衡离子浓度≤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。)6、某酒厂为减少CO2的排放,用石灰水吸收CO2,25℃达到沉淀溶解平衡时,测得溶液中c(CO2-)=0.010mol·L-1,求c(Ca2+)(写出计算过程,3已知:Ksp(CaCO)=2.8×10-9)。3答案Ksp(CaCO)=c(Ca2+)·c(CO2-)=2.8×10-9(2分)33c(Ca2+)×0.010mol·L-1=2.8×10-9(1分)c(Ca2+)=2.8×10-7mol·L-1(1分)(单位、有效数字错漏合扣1分)三、弱电解质的电离1、广二模试题回顾2、在0.10mol·L-1HAc溶液中加入固体NaAc,使其浓度为0.10mol·L-1(溶液体积不变),求溶液的[H+](或者说PH)。(已知K(Hac)=1.7×10-5)四、氧化还原反应有关计算。(电子守恒)略五、反应热的有关计算(特别是盖斯定律)1、试利用298K时下述反应的实验数据,计算此温度下2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g)的反应焓变。N(g)+2O(g)==2NO(g)△H=+67.7kJ•mol—12221N2H4(g)+O2(g)==N2(g)+H2O(g)△H2=—534kJ•mol—1\n2、2011.(广州二模)已知下列数据:Fe(s)+O(g)=FeO(s)△H=-272kJ·mol-122Al(s)+O(g)=AlO(s)△H=-1675kJ·mol-1223则2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)的△H是A.+859kJ·mol-1B.-859kJ·mol-1C.-1403kJ·mol-1D.-2491kJ·mol-1六、电化学有关计算题1、以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l)ΔH=-572kJ/mol某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为_____80%___。2、若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式。在上述所确定的电池中,若通入甲醚(沸点为-24.9℃)的速率为1.12L·min-1(标准状况),并以该电池作为电源电解2mol·L-1CuSO溶液500mL,则通电30s后理论上在阴极4可析出金属铜g。②CHOCH-12e-+16OH-=2CO2-+11HO(2分)3332③9.6(2分)七、百分含量的计算1、(2012惠州一模)(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.OOmL于锥形瓶中,用0.05mol/LAgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。①通过计算,样品含CaCl2·2H2O的质量百分数为——(只写计算式不计算结果)。147×20.40×10-3×0.05×10\n2×0.735×100﹪(5)①(3分)'(4)=(4分,其中:方程式2分,ΔH2分,漏单位扣1分,状态错漏0分。其他计量数,合理即给分)2、(3)探究小组为测定漂白粉中Ca(ClO)2的含量:称取漂白粉bg加水溶解后配制成100mL溶液,准确量取25.00mL于锥形瓶并加入足量盐酸和KI溶液,充分反应后,溶液中的游离碘用0.1000mol/L的Na2S2O3溶液滴定,滴定2次,平均消耗Na2S2O3溶液20.00ml。则该漂白粉中Ca(ClO)2的质量分数为______________。(只列算式,不做运算。已知:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,2Na2S2O3+I2=Na2S4O6+2NaI)(3)或或(3分,有效数字不准确,扣1分)