- 242.96 KB
- 2022-07-20 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
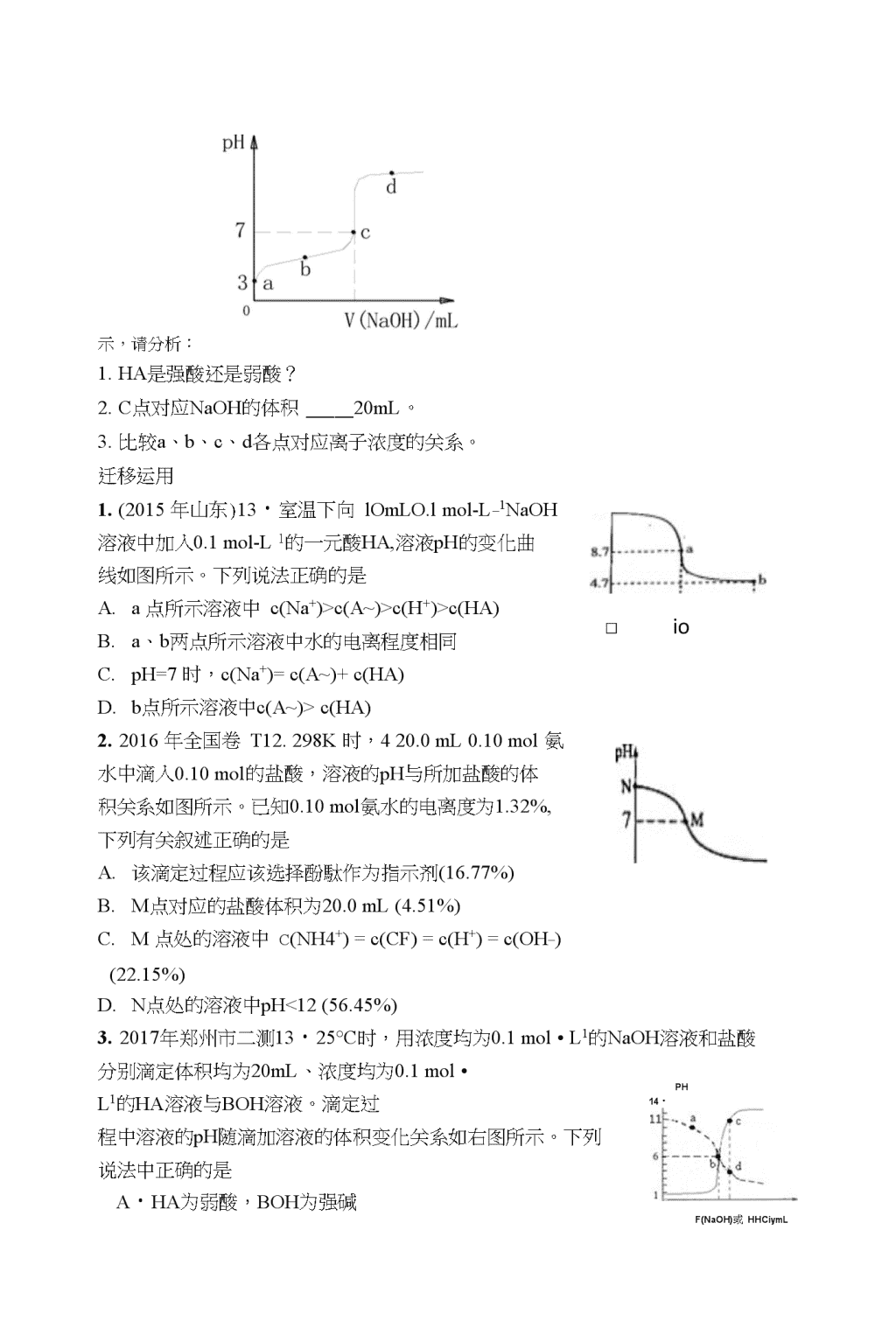
全国卷高考试题的答题技巧及解题模型一、高考理综化学答题注意事项1.化学用语:(I)结构简式、化学式、分子式、化合价、电子式、原子结构示意图见错0分。(2)化学方程式或离子方程式中化学式错误0分,反应条件、气体箭头、沉淀符号不做评分依据,不配平扣一半分。(3)热化学方程式和电极反应式见错0分。2.简答题按点给分,注意关键词3.计算题步骤、结果、单位分歩给分,关注有效数字4.仪器连接题不能出现科学性错误。5.实验设计和实验评价要答出木质性问题,遵循科学性、可行性、简约型和安全性。6.杜绝万能答题方法。二、2017年高考题展望1•元素化合物试题背景材料和设问指向更为丰富背景内容丰富多彩(以生产生活实际或实验现象分析为背景,以文字描述、工艺流程、物质间框图转化为基本形式)试题体现研究物质的基本方法,如读图(表)推理、书写化学方程式或离子方程式、化学计算、数据解读、推断结论。2.化学反应原理试题更强调数据阅读分析处理,凸现了图表信息的综合运用高考原理题将紧密联系实际,综合考查盖斯定律、化学反应速率、化学平衡、沉淀溶解平衡、电解质溶液、电化学等化学反应原理。3•化学实验试题更加关注实验操作的细节问题,关注实验设计及实验评价试题内容背景几乎均取之于牛产实际,特别是物质制备过程中的物质分离与提纯;仪器的使用,实验的注意事项。还要关注简单的计算问题。4•有机化学基础将会以合成框图为主要呈现形式内容取材于生活中各领域的化学物质,以合成框图为主要呈现形式,问题设置梯度明显,有机反应类型、有机物的命名、有机反应方程式的书写、同分异构体的确定和书写仍是命题重点。要关注对波谱知识和有机定量计算的考查。特别要关注合成路线的设计5•结构化学将会综合元素化学一起考查内容除考查原子结构、分子结构、超分子结构和晶体结构外,可能要揉合进元素化学。一般入题容易,梯度明显,设置有把关的步骤。\n三、试题分析\n□ioPH14・F(NaOH)或HHCiymL示,请分析:1.HA是强酸还是弱酸?2.C点对应NaOH的体积20mL。3.比较a、b、c、d各点对应离子浓度的关系。迁移运用1.(2015年山东)13・室温下向lOmLO.lmol-L_1NaOH溶液中加入0.1mol-L1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是A.a点所示溶液中c(Na+)>c(A~)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A~)+c(HA)D.b点所示溶液中c(A~)>c(HA)2.2016年全国卷T12.298K时,420.0mL0.10mol氨水中滴入0.10mol的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol氨水的电离度为1.32%,下列有关叙述正确的是A.该滴定过程应该选择酚駄作为指示剂(16.77%)B.M点对应的盐酸体积为20.0mL(4.51%)C.M点处的溶液中c(NH4+)=c(CF)=c(H+)=c(OH_)(22.15%)D.N点处的溶液中pH<12(56.45%)3.2017年郑州市二测13・25°C时,用浓度均为0.1mol•L1的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1mol•L1的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如右图所示。下列说法中正确的是A・HA为弱酸,BOH为强碱\nB.a点时,溶液中离子浓度存在关系:c(B+)>c(cr)>c(OH)>c(BOH)\nc.b点时两种溶液中水的电离程度相同,且V二20D.c、d两点溶液混合后微粒之间存在关系:c(H+)=c(OH)+c(BOH)例2.2016年全国一卷28.(14分)NaCIO?是一种重要的杀菌消毒剂,也常用来漂H织物等,其一种生产工艺如下:SO,NaOO,食盘水NaOOjAXNaHSO.N«OH、HA回答下列问题:(1)NaCIO2中Cl的化合价为。(2)写出“反应”步骤中生成CIO?的化学方程式o(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去M旷和Ca",要加入的试剂分别为、。“电解”中阴极反应的主要产物是(4)“尾气吸收”是吸收“电解”过程排出的少量CI02o此吸收反应屮,氧化剂与还原剂的物质的量之比为,该反应中氧化产物是0(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力oNaCI02的有效氯含量为—o(计算结果保留两位小数)迁移应用1.2015年全国一-卷27.(14分)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5H20和Fe3O4,还有少量Fe2O3>FeO、CaO>AI2O3和SiO?等)为原料制备硼酸(H3BO3)的工艺流程如图所示:铁硼矿粉T浸渣滤渣粗硼酸含镁盐母液回答下列问题:\n(1)写岀Mg2B2O5-H2O与硫酸反应的化学方程式o为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条)。(2)利用的磁性,可将其从“浸渣,冲分离「浸渣冲还剩余的物质是o(写化学式)(3)“净化除杂”需先加H2O2溶液,作用是o然后在调节溶液的pH约为5,目的是o(4)“粗硼酸”屮的主要杂质是(填名称)。(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为o(6)单质硼可用于生成具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程o1.2013年全国一卷27(15分)废旧.耗离子电池NaOHiff®水相(Li£O.涪液)正极敬浸锂离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钻酸锂(LiCoOQ,导电剂乙烘黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xL厂+xc一二LiG。现欲利用以下工艺流程回收正极材料屮的某些金属资源(部分条件未给出)。滤沦{亟涯浹H?SO4!H}O,滤浪fAI(OH)個体脊机相i有机相一*再生回用.coco)ra体_水榜(CoSO詣液〉—4洸因-4过滤NH.HC6洛浊回答下列问题:(1)LiCoOv屮,Co元素的化合价为o(2)写出“正极碱浸”屮发生反应的离子方程式o(3)“酸浸”一般在80°C下进行,写出该步骤屮发生的所有氧化还原反应的化学方程式;可用盐酸代替“SO-和IQ的混合液,但缺点是O\n(4)写出“沉钻”过程屮发生反应的化学方程式。(5)充放电过程屮,发生LiCo02与LirCoO?之间的转化,写出放电时电池反应方程式(6)上述工艺中,“放电处理”有利于锂在止极的回收,其原因是o在整个回收工艺中,可回收到的金属化合物有(填化学式)O例3・10.(2014北京理综,28,15分)用FeClj酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(兀)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):序号电压/V阳极现象检验阳极产物IxMa电极附近出现黄色,有气泡产生有Fe"、有Cl2na>xM1)电极附近出现黄色,无气泡产生有Fe3+、无Cl2inl)>X>0无明显变化无Fe3*、无Cl2(1)用KSCN溶液检验出F芒的现象是。(2)I中,Fe"产生的原因可能是C广在阳极放电,生成的Cl2将Fe2*氧化。写出有关反应:(3)由U推测,Ff产生的原因还可能是F/在阳极放电,原因是F/具有性。(4)n中虽未检验出CJ,但C「在阳极是否放电仍需进一步验证。电解pH二1的NaCl溶液做对照实验,记录如下:序号电压八阳极现象检验阳极产物IVa>xMe无明显变化有C1,■VC>X^l)无明显变化无C1,£(DNaCl溶液的浓度是mol/L。②IV中检验Cl’的实验方法:③与H对比,得/II的结论(写出两点):\n迁移应用1.(14分)某同学类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应进行了实验探究。依据要求回答问题:(1)二氧化碳的发生装置应选用上述装置中的(填装置序号),反应的化学方程式为O(2)为达到实验目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置一(按气流方向,用小写字母表示)。(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是.(4)该同学用稀盐酸与CaCO:,反应制备C02,向装置B中加入稀盐酸后,发现CaC03与稀盐酸没有接触。由于盐酸用完,为使反应顺利进行,可再加入的试剂是OA.稀硝酸B.H2S04溶液C.苯D.CC14(5)若反应过程中CO?足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2C03②生成的固体物质为N氐CO:;和C的混合物③生成的固体物质为瓯⑴和血0的混合物④生成的固体物质为Nd和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是;则钠与CO?反应的化学方程式为O(6)该同学经过反思,认为上述实验设计屮存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同吋得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为。