- 422.47 KB
- 2022-07-20 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
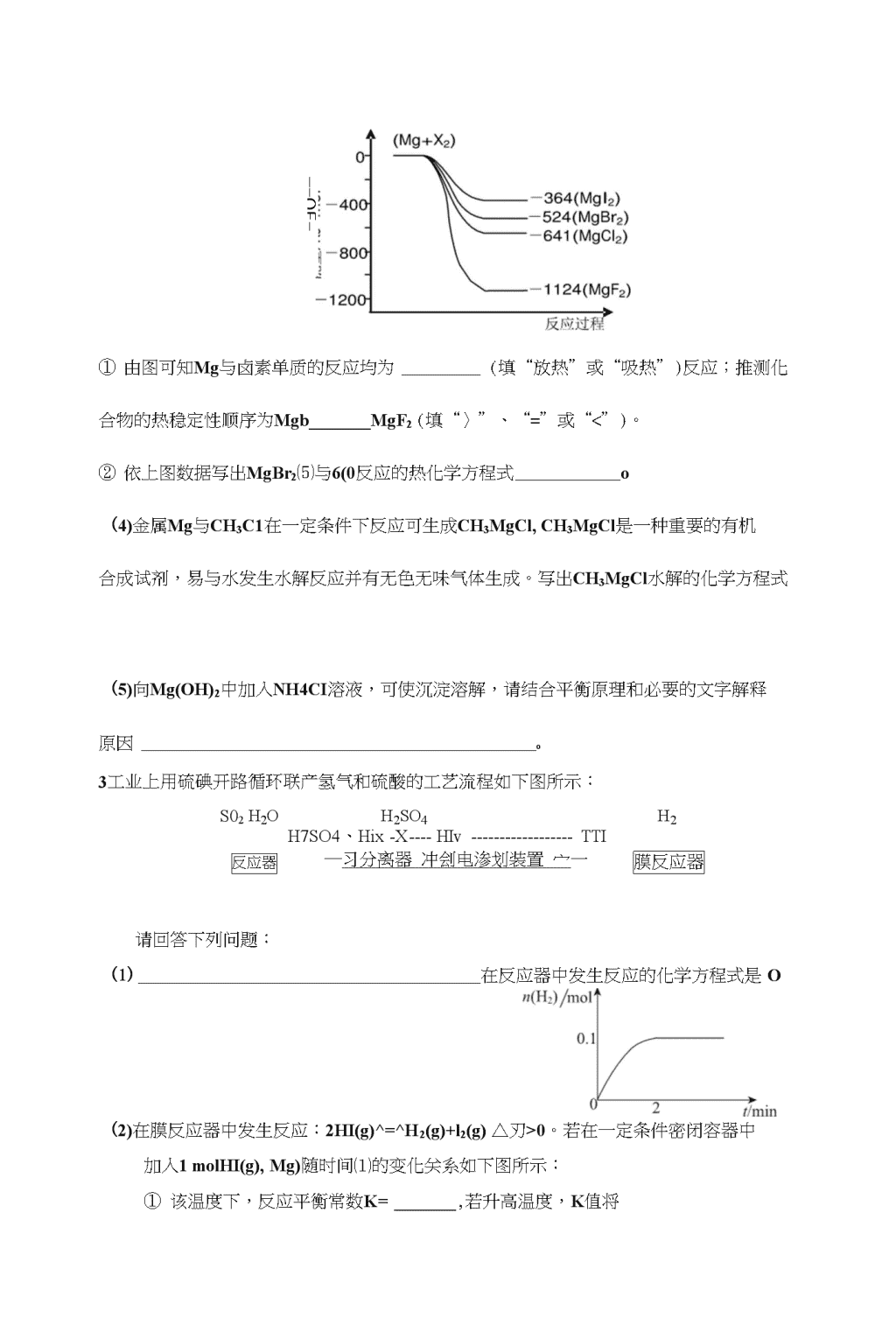
1硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。(1)工业制硫酸铜的方法很多。①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是,此法的最大缺点是O②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:铜粉稀硫酸、铜和氧化铁反应的化学方程式是;向混合溶液中通入热空气的反应的离子方程式是由滤液得到无水硫酸铜的实验操作是(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸钱。主要的工艺流程如下图所示:氨水尾气①吸收塔中发生反应的化学方程式是O②有数据表明,吸收塔中溶液的pH在5・5〜6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的方法是2海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:厂>粗盐蒸发海水结晶苦卤水(含KS试剂IMg(OH)2fM『+、Br—等)A沉淀盹(1)工业制取镁的方法是法。(2)试剂I一般选用(填化学式)。••\n(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。\n—-OE-2、田温①由图可知Mg与卤素单质的反应均为(填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgbMgF2(填“〉”、“=”或“<”)。②依上图数据写出MgBr2⑸与6(0反应的热化学方程式o(4)金属Mg与CH3C1在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式(5)向Mg(OH)2中加入NH4CI溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因o3工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:S02h2oh2so4h2H7SO4、HixXHIvTTI膜反应器反应器―习分离器冲刽电渗划装置宀一请回答下列问题:(1)在反应器中发生反应的化学方程式是O(2)在膜反应器中发生反应:2HI(g)^=^H2(g)+l2(g)△刃>0。若在一定条件密闭容器中加入1molHI(g),Mg)随时间⑴的变化关系如下图所示:①该温度下,反应平衡常数K=,若升高温度,K值将\n(填“增大”、“减小”或“不变”)。②用化学平衡原理解释使用膜反应器及时分离出H2的目的是(3)电渗析装置如下图所示:①结合电极反应式解释阴极区HI、转化为HI的原理是②该装置中发生的总反应的化学方程式是。(4)上述工艺流程中循环利用的物质是o4碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。(1)将CO?与焦炭作用生成CO,CO可用于炼铁等。①已知:Fe2O3⑸+3C(石墨)=2Fe⑸+3CO(g)+489.0kJ/molC(石墨)+CC>2(g)=2CO(g)AH2=+172.5kJ/mol则CO还原Fe2O3的热化学方程式为;②氯化耙(PdCI2)溶液常被应用于检测空气中微量COoPdCH被还原成单质,反应的化学方程式为;(1)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和02构成丙烷燃料电池。①负极电极反应式是:;②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是(填序号)A.电源中的2—定为正极,b—定为负极B.可以用NaCI溶液作为电解液C.A、B两端都必须用铁作电极D.阴极发生的反应是:2H++2e=H2t(2)将不同量的CO(g)和也0(刃分别通入体积为2L的恒容密闭容器中,进行反应:\nCO(g)+H2O(g)■一CO2(g)+H2(g),得到如下三组数据:实验组温度/°c起始量/mol平衡量/mol达到平衡所需时间h2oCOco2/min\n1650241.652900120.433900120.41①该反应的正反应为(填“吸”或“放”)热反应;②实验2中,平衡常数《=;③实验3跟实验2相比,改变的条件可能是(答一种情况即可);(4)将2・也碳在足量氧气中燃烧,所得气体通入100mL3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序。5利用电化学法生产硫酸,可使绝大多数硫磺直接转化为SO3,在生产硫酸的同时还能化学发电,请回答下列问题:能*(1)已知下列反应的能量变化示意图能▲启1■SO2(g)+|o2(g)AH=-98.7kJ/molSO3(g)-►R5Rvnd'i?①lmolS(g)与O2(g)完全反应生成SO2(g),反应的\H-297.0kJ/mol(填“〉”或“v”)②写出S⑸与。2仗)反应生成SO3(g)的热化学方程式o(2)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O'•离子。>S(s)V\n①正极反应式为O②S(g)在负极发生的反应为、③用化学方程式解释装置中稀硫酸转变为浓硫酸的原因④每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上可向用电器提供mol电子,将消耗mol氧气。⑤已知S(g)在负极发生的反应为可逆反应,请分析为提高硫磺蒸气的转化率,该工艺釆取的措施有O6工业上用某矿渣(含有C112O、AI2O3、Fe2O3>SiO2)提取铜的操作流程如下:稀硫酸NaClO过滤NaOH矿渣反应I固体混合物A调pH=xI沉淀B调pH=yl沉淀cCu已知:Cu2O+2H+=Cu+Cu2++H2O沉淀物Cu(OH)2A1(OH)3Fe(OH)3Fe(OH)2开始沉淀pH5.44.01.15.8沉淀完全pH6.75.23.28.8(1)固体混合物A中的成分是o(2)反应I完成后,铁元素的存在形式为o(填离子符号)请写出生成该离子的离子方程式o(3)x、y对应的数值范围分别是、o(4)电解法获取Cu时,阴极反应式为,阳极反应式为。(5)下列关于NaClO调pH的说法正确的是oa.加入NaClO可使溶液的pH降低\na.NaClO能调节pH的主要原因是由于发生反应C1O+H+^^HC1O,\nCIO—消耗H+,从而达到调节pH的目的c.NaClO能调节pH的主要原因是由于NaCIO水解C1O+H2OHC1O+OH-,OIT消耗H+,从而达到调节pH的目的(6)用NaCIO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为o7海洋资源的开发与利用具有广阔的前景。海水的pH-般在7・5〜8.6之间。某地海水中主要离子的含量如下表:成分Na+K+Ca2+Mg2+crHCO/含量9360832001100160001200118(1)海水显弱碱性的原因是(用离子方程式表示):,该海水中Ca2+的物质的量浓度为moI/Lo(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。阳邑审離療「林石4L>>b阴«+養膜「阴8丈余膜电燼析原理示意图①阴极的电极反应式为O②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCOs的离子方程式o③淡水的出口为a、b、c中的出口。(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFcPO4电池某电极的工作原理如下图所示:LiFePO4FePOd\n该电池电解质为能传导“的固体材料。放电时该电极是电池的极(填“正”或“负”),电极反应式为o\n(4)利用海洋资源可获得MnO2oM11O2可用来制备高猛酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的镒酸钾(K2M11O4),再利用氯气将镒酸钾氧化成高猛酸钾。该制备过程中消耗相同条件下空气和氯气的体积比为(空气中氧气的体积分数按20%计)。8PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的SO?和NOx。旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示:净化气排空水生石灰熟化池石灰浆高速旋转>>雾化器——>CaSO4含SO2、。2、N2等的烟气(1)写出高速旋转雾化器中发生反应的化学方程式O(2)在一定条件下,SO2可被氧气氧化,每生成8gSO3气体,放出9.83kJ的热量。写出该反应的热化学方程式o(3)500°C时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后:①两容器中SO3的体积分数关系是I—II(填“〉”、或“=”)。若测得容器II中的压强减小了30%,则该容器中SO2的转化率为o②h时刻分别向两容器的平衡体系中加入2molSO3,则两容器中SO3的体积分数随时间变化曲线图正确的是(填序号)。时间t/mm时问t/rnm心的体积分数时间t/minlihsSO3的体积分数时问t/minCD\n(4)NO”可用强碱溶液吸收产生硝酸盐。在酸性条件下,FeSO4溶液能将NO,还原为NO,NO能与多余的FeSO4溶液作用生成棕色物质,这是检验NO3-的特征反应。写岀该过程中产生NO反应的离子方程式。1(1)①Cu+2H2SO4(浓)==CuSO4+SO2t+2H2O产生有污染的气体②Fe2O3+6H+==2Fe3++3H2O>2Fe3++Cu==2Fe2++Cu2+(或Fe2O3+Cu+6H+==3H2O+2Fe2++Cu2+)4Fe2++4H++O2==4Fe2++2H2O加热、蒸发(2)①4NH3H2O+2SO2+O2==2(NH4)2SO4+2H2O②调节氨水的流量2(1)电解法或电解熔融氯化镁(2)Ca(OH)2(3)①放热(该空1分),v②MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l)z47/=-117KJmol-1(4)CH3MgCl+H2O=CH4t+Mg(OH)ClI或2CH3MgCl+2H2O=2CH4t+Mg(OH)2I+MgCl2(5)Mg(OH)2(s)Mg2+(aq)+2OH一(aq),鞍根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。3(1)SO2+xI2+2H2O=H2SO4+2HIX(2)①1/64增大②及时分离出H2,使平衡正向移动,提高HI的分解率。(3)①在阴极区发生反应:I厂+(x-l)e"=xr,且阳极区的H+通过交换膜进入阴极区,得以生成HI溶液。电解②2HIX====(x-1)I2+2HI(4)I24(1)\n①Fe2O3⑸+3CO仗)=2Fe⑸+3CC>2(g)\H=・28.5kJ/moI②PdCl2+CO+H2O=Pd+CO2+2HCl(2)①C3H8-20e+26OH=3CO32+17H2O②BD(3)①放热②K=*③使用了催化剂;加大了压强(4)f(Na+)>c(HCO3)>c(CO32)>c(OH)>c(H+)52(1)①v(1分)②S(s)+2O2(g)=SO3(g)=-395.7kJ/mol(2分)(2)①O2+4e_=2O2'(2分)②S-4e_+2O2=SO2S-6e~+3O2=SO3(各1分)(3)SO3+H2O=H2SO4(2分)(4)110.427.6(各1分)(5)硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率)(各1分,不写括号内内容不扣分)1SiO2>Cu(各1分)Fe2+(2分)2Fe3++Cu=Cu2++2Fe2+(2分)3・2WpHV4・05・2WpHV5・4(各1分)Cu2++2e~=Cu20-2e_=Cht(各1分)b(2分)5C1O+2Fe2++5H2O=2Fe(OH)3+C\~+4HC1O(1分)(或2Fe2++7ClO+2H++5H2O=2Fe(OH)3+Cr+6HC1O)2(1)HCO3+H2O=H2CO3+OH5X10'3\n(2)①2H2O+2e-=H2t+2OH(2H++2e=Hzt)②Ca2++OH+HCO3=CaCOaI+H2O③b(1分)(3)正FePO4+e+Li+=LiFePO4(4)5:11(1)2SO2+2Ca(OH)2+O2=2CaSO4+2H2O(2)2SO2(g)+O2(g)=2SO3(g)A//=-196.6kJ/mol(3)①>90%②A(4)3Fe2++NO/+4H+=3Fe并+NOf+2H2O