- 229.50 KB
- 2022-07-21 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
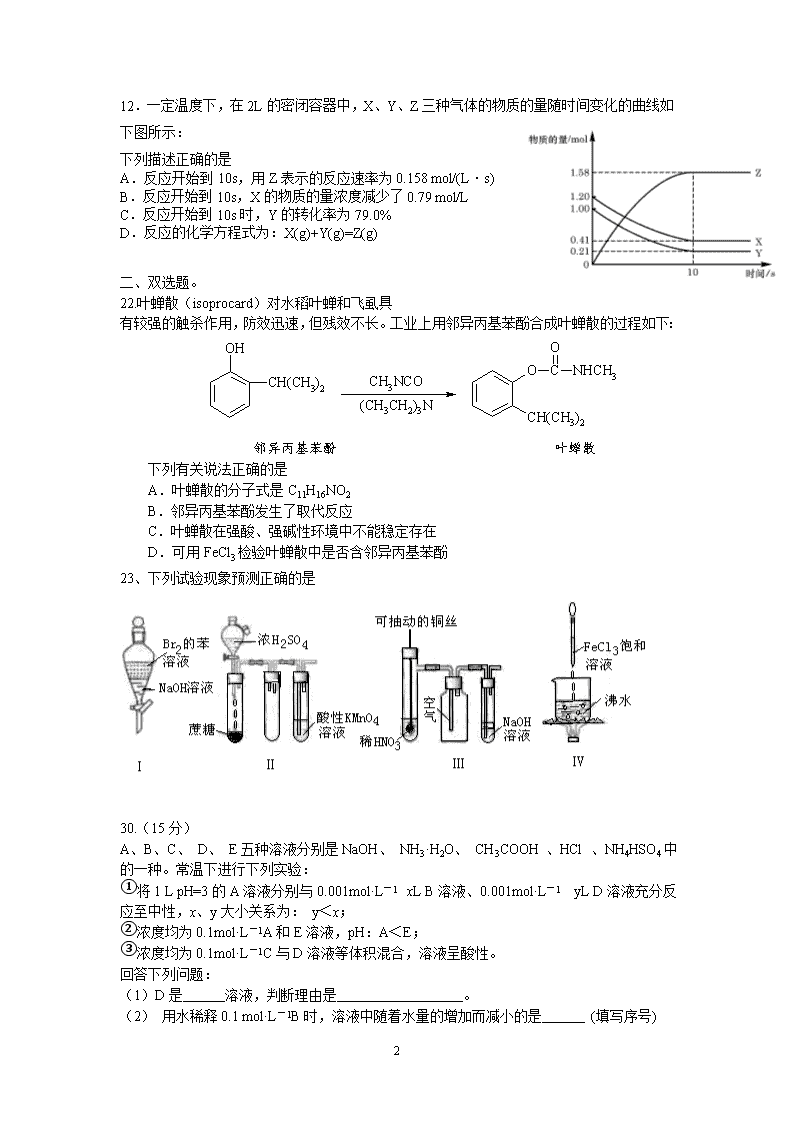
广东高考(化学部分)一、单算题.7.设NA代表阿伏加德罗常数,下列说法正确的是A.5.6g铁与足量盐酸反应转移的电子数为0.3NAB.100mL2.0mol/L的盐酸与醋酸溶液中氢离子均为0.2NAC.标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NAD.20g重水(D2O)中含有的电子数为10NA8.下列溶液中,一定能大量共存的微粒组是()A.pH=1的溶液中:K+、Cr2O2-7、CH3CH2OH、SO2-4B.含有大量Fe3+的溶液中:Al3+、Cu2+、Cl—、SO2-4C.加入Al能放出H2的溶液中:K+、NH+4、NO—3、Cl—D.滴加紫色石蕊试液变红的溶液中:K+、Ba2+、NO—3、F—9.下列说法正确的是A.IA族元素的金属性比ⅡA族元素的金属性强B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强D.第三周期元素的离子半径从左到右逐渐减小10.下表对某些反应方程式的评价合理的是()编号离子方程式或电极反应式评价A次氯酸钙溶液中通入足量SO2Ca2++C1O—+SO2+H2O=CaSO4+C1—+2H+正确B硫酸铁溶液与氢氧化钡溶液混合Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓正确C醋酸铵溶于水CH3COO—+NH4+CH3COOH++NH3·H2OH2OCH3COOH+NH3·H2O错误,阴离子水解相互促进,应该用“=”号D用惰性电极电解氯化铜和氯化钠的混合溶液一段时间阴极:2Cu3++4e—=2Cu阳极:4OH—-4e—=2H2O+O2↑错误,该阴阳两极反应不可能同时发生11.下列描述中,不符合生产实际的是A.电解熔融的氧化铝制取金属铝,用铁作阳极B.电解法精炼粗铜,用纯铜作阴极C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D.在镀件上电镀锌,用锌作阳极6\n12.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始到10s,X的物质的量浓度减少了0.79mol/LC.反应开始到10s时,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)=Z(g)二、双选题。22.叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长。工业上用邻异丙基苯酚合成叶蝉散的过程如下:邻异丙基苯酚叶蝉散下列有关说法正确的是A.叶蝉散的分子式是C11H16NO2B.邻异丙基苯酚发生了取代反应C.叶蝉散在强酸、强碱性环境中不能稳定存在D.可用FeCl3检验叶蝉散中是否含邻异丙基苯酚23、下列试验现象预测正确的是30.(15分)A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:①将1LpH=3的A溶液分别与0.001mol·L-1xLB溶液、0.001mol·L-1yLD溶液充分反应至中性,x、y大小关系为:y<x;②浓度均为0.1mol·L-1A和E溶液,pH:A<E;③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。回答下列问题:(1)D是溶液,判断理由是。(2)用水稀释0.1mol·L-1B时,溶液中随着水量的增加而减小的是(填写序号)6\n①;②;③c(H+)和c(OH-)的乘积④OH-的物质的量(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)①反应所需要的时间E>A②开始反应时的速率A>E③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号)。(5)室温下,向0.01mol·L-1C溶液中滴加0.01mol·L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。31.(16分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。阳离子K+Cu2+Fe3+Al3+Fe2+阴离子Cl-CO32-NO3-SO42-SiO32-甲同学欲探究废水的组成,进行了如下实验:Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。Ⅱ.取少量溶液,加入KSCN溶液无明显变化。Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。请推断:(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为_______________________________________________________________(4)甲同学最终确定原溶液中所含阳离子是,阴离子是。(写离子符号)(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是()选项污染物处理措施方法类别A废酸加生石灰中和物理法BCu2+等重金属离子加硫酸盐沉降化学法C含复杂有机物的废水通过微生物代谢物理法6\nD碱性的废水用CO2来中和化学法32.(17分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。(1)下列有关说法正确的是 。a.生物质能,本质上能量来源于太阳能b.由纤维素水解获得的乙醇作燃料是利用了生物质能c.生物质裂解获得的汽油、柴油等属于纯净物d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。a.汽油b.甲醇c.甲醛d.乙酸(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H=-90.8kJ·mol-1。若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:容器甲乙丙反应物投入量1molCO、2molH21molCH3OH2molCO、4molH2CH3OH的浓度(mol/L)c1c2c3反应的能量变化放出Q1kJ吸收Q2kJ放出Q3kJ平衡常数K1K2K3反应物转化率α1α2α3下列说法正确的是。a.c1=c2b.2Q1=Q3c.K1=K3d.α2+α3<100%(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)①若一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“>”、“<”或“=”),理由是。平衡时n(CH3OCH3)=mol。②右图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。b电极是极;a电极的反应式为。33.(16分)6\n近年来,我国部分地区相继发现一些以发热伴血小板减少为主要表现的感染性疾病病例。氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下:氯吡格雷NaCNNH4ClH+,90℃H+CH3OHH+X(C6H7BrS)ABCDEX的结构简式为。⑴分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式。⑵C→D的反应类型是反应,物质D有两种结构,但只有一种能合成具有药理作用的氯吡格雷。物质D有两种结构的原因是。⑶出A能属于芳香族化合物的所有同分异构体的结构简式:。⑸已知:ROHH+ROHH+写出由乙烯、甲醇为有机原料制备化合物的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:CH3CH2OHCH2=CH2答案一、单项选择7.D8.A9.B10.D11.A12.C13.A二、双项选择22.CD23.BD30.【参考答案】(15分)(1)NaOH(2分)6\n中和酸性物质A只有NaOH、NH3·H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH。(3分)(2)①②(2分)(3)③④⑤(3分)(4)④(2分)(5)c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)(3分)31.【参考答案】共16分,每空2分。(1)K+Fe3+(2)3Fe2++NO3-+4H+=3Fe3++NO+2H2O(3分)(3)3NO2+H2O=2HNO3+NO(3分)(4)Fe2+Cu2+Cl-NO3-SO42-(5)1.6g(6)D32.【参考答案】(17分)(1)abd(3分,选对一个给1分,选错一个倒扣1分)(2)cd(2分,选对一个给1分,错选不给分)(3)ac(2分,选对一个给1分,错选不给分)(4)①>(1.5分);反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正移。(2.5分)1.75(2分)②正(1.5分);(CH3)2O-12e-+3H2O=2CO2+12H+(2.5分)33.【参考答案】(16分)⑴(1.5分)一定条件⑵2+2H2O(3分)⑶酯化(取代)(1分)由于D中存在手性碳,所以结构不止一种,应先进行分离(1分)⑷、(1.5分)(1.5分)、(1.5分)⑸H+C2H4Br2CH2BrCH2BrNaOH/H2O△CH2OHCH2OHCH3OHCu/O2△HCHO(5)6