- 341.00 KB
- 2022-08-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
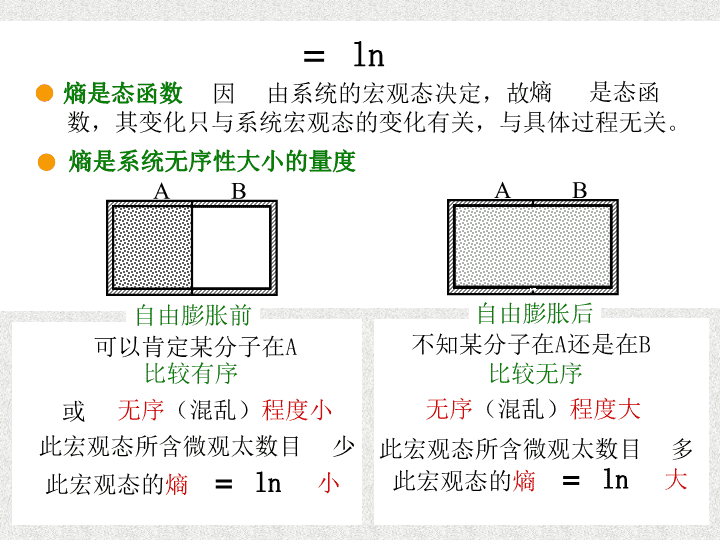
玻耳兹曼熵公式熵的统计定义式玻耳兹曼公式ln系统处于该宏观态时的熵系统处于某一宏观态的热力学概率(即该宏观态所含微观态的数目)玻耳兹曼常量熵是态函数熵有可加性熵是系统无序性的量度熵的几个重要性质分述如下:16-2\n熵的性质ABln熵是态函数熵是态函数,其变化只与系统宏观态的变化有关,与具体过程无关。由系统的宏观态决定,故因自由膨胀后熵是系统无序性大小的量度自由膨胀前AB可以肯定某分子在A不知某分子在A还是在B比较有序比较无序或无序(混乱)程度小无序(混乱)程度大此宏观态所含微观太数目少ln此宏观态的熵小ln此宏观态的熵大此宏观态所含微观太数目多\n续上ABln熵是态函数熵是态函数,其变化只与系统宏观态的变化有关,与具体过程无关。由系统的宏观态决定,故因自由膨胀后熵是系统无序性大小的量度自由膨胀前AB熵的性质可以肯定某分子在A不知某分子在A还是在B比较有序比较无序或无序(混乱)程度小无序(混乱)程度大此宏观态所含微观太数目少ln此宏观态的熵小ln此宏观态的熵大此宏观态所含微观太数目多熵是态函数熵是系统无序性大小的量度熵具有可加性若一个系统由两独立事件出现的总概率是这两个事件概率的乘积。因此,两个独立的分系统A、B组成,对于某一宏观态,合系统的热力学概率是两个分系统的热力学概率的乘积,即。合系统的熵lnlnlnln是各分系统的熵之和上述几点性质使熵在许多领域得到广泛应用这种相乘关系在熵的表达式中变为相加关系\n熵增加原理熵增加原理继续深入分析理想气体自由膨胀过程自由膨胀前ABAB自由膨胀后系统特点:气体向真空部分膨胀,整个系统没有对外作功。孤立系统,与外界绝热并且无其它能量和物质交换。绝热△Q=0,无功A=0,膨胀前后理想气体内能不变温度不变理想气体自由膨胀过程是不可逆过程自由膨胀过程中总是朝着热力学概率大的方向进行,亦即孤立系统中的不可逆过程,其微过程的熵变朝着熵增加的方向进行的,此过程的熵变,通常表达为\n等温膨胀推熵变然而,在热力学中经常要用准静态过程的理论模型去研究问题,准静态过程是可逆过程。孤立系统中可逆过程的熵变化又有何特点呢?此过程的熵变lnlnln可以证明分子数N(T,V1)宏观态微观态数W1分子数N宏观态(T,V2)微观态数W2理想气体等温膨胀例如:\n续上然而,在热力学中经常要用准静态过程的理论模型去研究问题,准静态过程是可逆过程。孤立系统中可逆过程的熵变化又有何特点呢?分子数N(T,V1)宏观态微观态数W1分子数N宏观态(T,V2)微观态数W2理想气体等温膨胀此过程的熵变lnlnln可以证明例如:将作二等分,为便于理解假设则再假设膨胀后即则可见\n续上此过程的熵变lnlnln可以证明然而,在热力学中经常要用准静态过程的理论模型去研究问题,准静态过程是可逆过程。孤立系统中可逆过程的熵变化又有何特点呢?理想气体等温膨胀例如:再假设膨胀后即则可见将作二等分,为便于理解假设则分子数N微观态数W1(T,V1)宏观态分子数N宏观态(T,V2)微观态数W2ln则其中得ln\n续上等式两边乘以温度ln将上述结果ln这是热力学中讲过的等温可逆过程系统吸收的热量故得若系统在任意微小的等温可逆过程中吸收的热量为则此微过程的熵变根据热力学第一定律的微分形式是计算热力学过程中熵变的基本公式熵和熵变的单位是焦耳·开–1(J·K–1)\n熵增原理表达式上述从等温可逆过程推出的熵变表达式对于其它准静态过程(可逆过程)都成立。如果系统是孤立或绝热系统,则在它所发生的一切可逆过程中则将上述可逆和前面讲过的不可逆种情况综合起来表达不可逆过程可逆过程取取熵增加原理孤立(或绝热)系统内部所发生的过程不可逆时,其熵增加;所发生的过程可逆时,其熵不变。对于孤立(或绝热)系统整体,其熵有增无减。可见,熵与能量或动量不同,它不遵守“守恒定理”。至于孤立(或绝热)系统内的个别物体,其熵则可能有增有减。但对于孤立系统整体,其熵只能有增无减。若讨论对象不能看成孤立或绝热系统,其熵并非只能有增无减,例如,不把热源包括在内的理想气体可逆放热过程,其熵值减少。\n熵判据熵判据熵增加原理指出,孤立(或绝热)系统中不可逆过程总是自发地向着熵增加的方向进行的,与热力学第二定律的统计意义完全一致。从熵值的变化可判别过程的方向:熵增加原理是热力学第二定律的熵表达由熵值小的态指向熵值大的态。热平衡的熵判据对于孤立系统内的各种可能状态而言,平衡态的熵最大。也可将熵看成是孤立(或绝热)系统是否接近平衡态的量度:熵值越大,表示系统越接近平衡态。\n熵的计算熵的计算可逆过程可逆过程不熵是态函数,系统从某一状态A变化到另一状态B时,不论经历什么过程,其熵的变化相同。只要知道始、末平衡态的状态参量,就可以假设一个可逆过程,根据可逆过程熵变的定义式计算熵变对于理想气体\n例一质量为M,摩尔质量为m的理想气体由状态(TA,VA)变化到状态(TB,VB)的熵变值。解法提要代入后得其中lnln\n例二已知冰的溶解热为3.35×105J·kg-11kg0℃的冰化成同温度的水的熵变解法提要此过程可看成等温过程T=273.0K全过程吸热Q=1kg×3.35×105J·kg-1=3.35×105J熵变3.35×105J273.0K1.23×103J·K-1