- 320.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012年中考模拟卷一
化学
(满分:80分;考试时间:100分钟)
可能用到的相对原子质量: C: 12 Fe: 56 O:16 H:1 N:14 Cu:64 Ca:40
一、选择题(本题共15小题,每小题只有一个选项符合题意。每小题1分,共15分)
1.实验室里几种物质正在互相谈论着。你认为它们的叙述中属于化学变化的是
A.试管:“同学们不爱惜我,我被摔碎了”
B.铁钉:“好难受啊,我在潮湿空气中生锈了”
C.酒精灯:“帽子哪里去了,我的燃料越来越少啦”
D.浓硫酸:“怎么我在空气中放置一段时间质量增加了”
2.下列物质属于碱的是
A.CO2 B.HCl C.NH3·H2O D.K2SO4
3.下列说法不正确的是
A.水银不是银而是汞 B.有机玻璃不是玻璃是塑料
C.玻璃钢不是玻璃而是钢 D.纯碱不属于碱而属于盐
4.“闻香识茶”意思是通过闻的方法判断出茶的类别。人们能够闻到茶香的原因是
A.分子之间存在间隔 B.分子质量和体积很小
C.分子在不断的运动 D.分子是由原子构成的
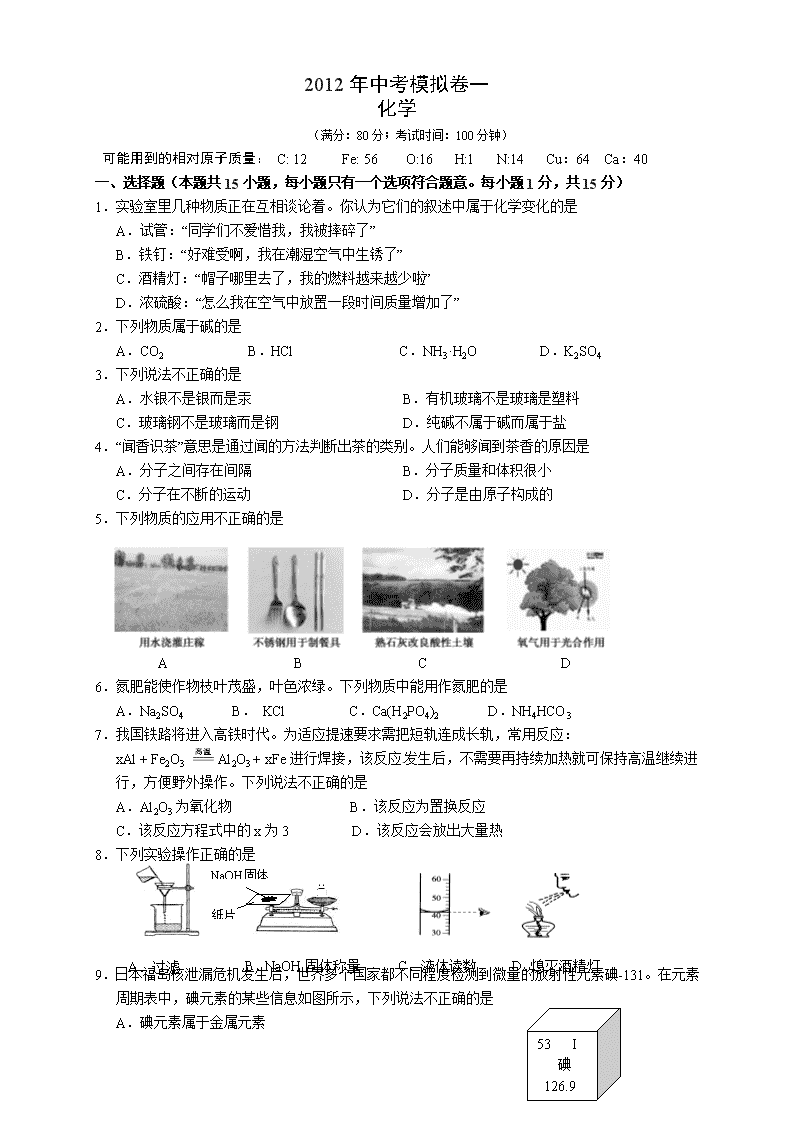
5.下列物质的应用不正确的是
www.zk5u.com中考资源网
A B C D
6.氮肥能使作物枝叶茂盛,叶色浓绿。下列物质中能用作氮肥的是
A.Na2SO4 B. KCl C.Ca(H2PO4)2 D.NH4HCO3
7.我国铁路将进入高铁时代。为适应提速要求需把短轨连成长轨,常用反应:
xAl + Fe2O3 Al2O3 + xFe进行焊接,该反应发生后,不需要再持续加热就可保持高温继续进行,方便野外操作。下列说法不正确的是
A.Al2O3为氧化物 B.该反应为置换反应
C.该反应方程式中的x为3 D.该反应会放出大量热
NaOH固体
8.下列实验操作正确的是
纸片
D.熄灭酒精灯
C.液体读数
B.NaOH固体称量
A.过滤
9.日本福岛核泄漏危机发生后,世界多个国家都不同程度检测到微量的放射性元素碘-131。在元素周期表中,碘元素的某些信息如图所示,下列说法不正确的是
53 I
碘
126.9
A.碘元素属于金属元素
B.碘元素原子的核电荷数为53
C.碘元素原子的核外电子数为53
D.碘元素的相对原子质量为126.9
10.“纸火锅”(如右下图)是用纸张代替金属材料做容器盛放汤料,当酒精燃烧时纸张不会燃烧。对此现象,下列解释合理的是
A.纸张不是可燃物,不能燃烧
B.纸张被水浸湿,导致着火点降低
C.水蒸发时吸热,温度达不到纸张的着火点
D.空气不充足,纸张不会燃烧
11.为探究Zn和Cu的金属活动性强弱,提供的试剂有:Zn、Cu、H2SO4溶液、ZnSO4溶液、CuSO4溶液。下列说法正确的是
A.选用两种试剂可实现实验目的
B.ZnSO4溶液中加入Cu不能探究金属活动性强弱
C.最多只能设计一种实验方案
D.根据 Zn和Cu的硬度能判断金属活动性强弱
12.右图是甲乙两物质的溶解度曲线,下列说法中错误的是
A.t1℃时,甲的溶解度小于乙的溶解度
B.t2℃时,甲和乙的饱和溶液中含有溶质的质量相等
C.将t3℃的甲物质的饱和溶液降温到t2℃时会析出晶体
D.当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲
13.下列说法正确的是
A.煤、石油、乙醇是三种重要的化石燃料
B.洗洁精能除去餐具的油污是“乳化作用”
C.淀粉、油脂、蛋白质中均含有C、H、O、N等元素
D.“白色污染”是指白色建筑材料垃圾引起的污染
14.右图表示的是A、B、C三种溶液两两混合发生反应的实验现
象,符合该实验现象的A、B、C三种溶液依次是
A.盐酸、碳酸钠溶液、氢氧化钠溶液
B.氯化钠溶液、澄清石灰水、氢氧化钠溶液
C.盐酸、碳酸钠溶液、澄清石灰水
D.氢氧化钙溶液、盐酸、硫酸钠溶液
15.在由CH4和H2组成的混合气体中,测知碳元素的质量分数为60%,则混合气体充分燃烧生成二氧化碳和水的质量比为
A.11∶18 B.22∶9 C. 1∶1 D.11∶27
二、选择题(本题共5小题,每小题有一个或二个选项符合题意。错选、多选不给分。有二个答案的,只选一个且正确,给1分。每小题2分,共10分)
16. 用右图所示密闭装置进行实验,使固体与液体接触,能够观察到气球先膨胀,过一段时间又恢复到原状的一组物质是
A.硝酸铵和水 B.铁粉和稀硫酸
C.碳酸钠和稀硫酸 D.氯化钠和水
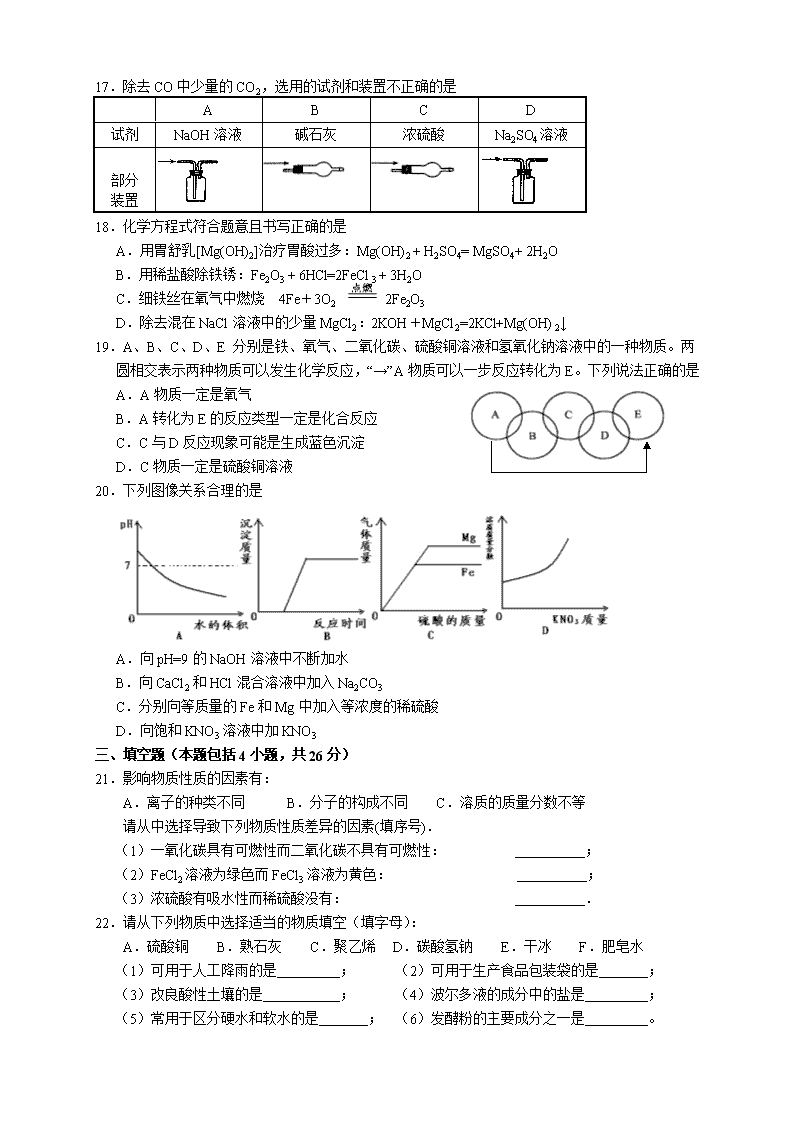
17.除去CO中少量的CO2,选用的试剂和装置不正确的是
A
B
C
D
试剂
NaOH溶液
碱石灰
浓硫酸
Na2SO4溶液
部分
装置
18.化学方程式符合题意且书写正确的是
A.用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2 + H2SO4= MgSO4+ 2H2O
B.用稀盐酸除铁锈:Fe2O3 + 6HCl=2FeCl3 + 3H2O
C.细铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
D.除去混在NaCl溶液中的少量MgCl2:2KOH+MgCl2=2KCl+Mg(OH)2↓
19.A、B、C、D、E 分别是铁、氧气、二氧化碳、硫酸铜溶液和氢氧化钠溶液中的一种物质。www.zk5u.com中考资源网两
圆相交表示两种物质可以发生化学反应,“→”A物质可以一步反应转化为E。下列说法正确的是
A.A物质一定是氧气
B.A转化为E的反应类型一定是化合反应
C.C与D反应现象可能是生成蓝色沉淀
D.C物质一定是硫酸铜溶液
20.下列图像关系合理的是
A.向pH=9的NaOH溶液中不断加水
B.向CaCl2和HCl混合溶液中加入Na2CO3
C.分别向等质量的Fe和Mg中加入等浓度的稀硫酸
D.向饱和KNO3溶液中加KNO3
三、填空题(本题包括4小题,共26分)
21.影响物质性质的因素有:
A.离子的种类不同 B.分子的构成不同 C.溶质的质量分数不等
请从中选择导致下列物质性质差异的因素(填序号).
(1)一氧化碳具有可燃性而二氧化碳不具有可燃性: ;
(2)FeCl2溶液为绿色而FeCl3溶液为黄色: ;
(3)浓硫酸有吸水性而稀硫酸没有: .
22.请从下列物质中选择适当的物质填空(填字母):
A.硫酸铜 B.熟石灰 C.聚乙烯 D.碳酸氢钠 E.干冰 F.肥皂水
(1)可用于人工降雨的是 ; (2)可用于生产食品包装袋的是 ;
(3)改良酸性土壤的是 ; (4)波尔多液的成分中的盐是 ;
(5)常用于区分硬水和软水的是 ; (6)发酵粉的主要成分之一是 。
23.完成下列化学方程式:
(1)电解水
(2)赤铁矿炼铁
(3)实验室制二氧化碳的原理
(4)甲烷燃烧
24.下图为某反应在同一容器中反应前后部分分子种类的示意图。回答下列问题:
(1) 氮元素和氢元素的本质区别是 ,1个A分子中共含有 个原子,C代表的物质是 。
(2)反应物中缺少某种物质,在反应前方框内应补充的微粒是 (填序号)。
(3)该反应中B和C的质量比为 。
25.现有生活中常见的四种未知白色粉末,它们分别是氯化钠、纯碱、去污粉(成分为碳酸钠和碳酸钙)和使用过的生石灰干燥剂。化学小组为了确定每种未知固体的成分,将它们分别标记为①、②、③、④后进行实验,实验现象记录如下:
实验过程
实验现象
实验1: 分别取样于四支试管中,加入足量的水充分溶解
②、③ 完全溶解,①、④ 均在试管底部有白色固体,且①中有明显放热
实验2:实验1中四支试管静置一段时间后,分别取上层清液,加入试剂A
③、④均有气泡产生
实验3:分别取原固体粉末少量于四支试管中,加
入足量试剂A
白色固体均消失;①③④均有气泡产生
根据以上实验现象,回答下列问题:
(1)实验1中,物质①发生反应的化学方程式是 。
(2)物质②为 ,试剂A为 。(本题均用化学式填空)
(3)实验3中,试剂A与物质④发生反应的化学方程式是 、 。
(4)通过实验判断,物质①中一定含有的成分是 。
(5)有五瓶失去标签的溶液,他们的溶质分别是①Ba(NO3)2 ②KCl ③NaOH ④Fe2(SO4)3 ⑤Na2SO4。不用其他试剂,首先鉴别出来的试剂是 (用编号填空)
四、(本题包括2小题,共30分)
26.纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程。请回答下列问题:
(1)试剂A的化学式 ,若在实验室中进行该实验,操作1和操作2的名称是 ,该实验中玻璃棒的作用 。
(2)该工艺中生成碳酸钡固体的反应方程式为:BaCl2 + +2KOH=BaCO3+2 + ,请完成并配平该方程式。
(3)操作3为洗涤、检验和 ,洗涤的作用是 ,检验洗涤是否干净可选用试剂 (写化学式)。
(4)上述流程中可循环利用的物质是 ,该流程中的副产物可用作 。(写一种用途)
(5)分析该流程可得出SiO2部分性质,下列属于其物理性质 ,化学性质 。(填序号)
A.不溶于水 B.可溶于水 C.不与盐酸反应 D.能与盐酸反应
(6)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na2SiO3),该反应的化学方程式 。根据此原理该同学设计出如下方案制备:取碳酸钡和二氧化硅混合物,滴加 (填“少量”或“过量”)的氢氧化钠溶液,过滤,洗涤,烘干得碳酸钡固体。
27.取化学式为MO的黑色氧化物进行如下实验。将MO和碳粉充分混合物,平铺在玻璃管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热玻璃管a。待反应完全后,停止加热, ,直至玻璃管冷却,此时,管中有红色金属生成。
根据以上叙述回答:
(1)元素M是 ;M的氧化物除MO外,还有一种氧化物的化学式为 。
(2)A仪器的名称 ,实验过程中b装置中的实验现象有 ,反应的化学方程式 。
(3)实验前为什么要将MO与C充分混合? ,玻璃管a中发生的反应有2MO+C2 M+CO2↑和 (请再举一例,用化学方程式表示),请补全题干中的实验步骤 。
(4)实验开始时先缓缓通入氮气,过一段时间后,再加热玻璃管a的原因
。停止加热前是否需要先断开a和b的连接处? (填“是”或“否”)为什么? 。
(5)若反应管a中只发生反应2MO+C2 M+CO2↑,则1.8g的MO与0.12g的C充分反应,生成的二氧化碳至少需要溶质质量发生为0.1%的澄清石灰水多少g才能完全吸收,转化为碳酸钙?(MO的相对分子质量为80)(本题2分,写出计算过程)
②反应后,玻璃管a中剩余的固体是 ,质量比为 。
参考答案
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
C
C
D
D
C
C
A
C
题号
11
12
13
14
15
16
17
18
19
20
答案
A
B
B
C
A
A
CD
B
CD
BC
21.(1)B (2) A (3) C
22.(1)E (2)C (3)B (4)A (5)F (6)D
23. 略
24.(1)质子数不同或核电荷数不同 4 H2O
(2)③
(3)5:9
25.(1)CaO+ H2O= Ca(OH)2
(2)NaCl HCl
(3)Na2CO3+2HCl= 2NaCl+H2O+CO2↑ CaCO3+2HCl= CaCl2+H2O+CO2↑
(4)CaO、CaCO3
(5)④
26.(1)HCl 过滤 引流
(2) CO2 KCl H2O
(3)烘干 除去沉淀表面可溶性杂质或残留滤渣表面滤液 AgNO3
(4)CO2 钾肥或钾盐
(5)A C
(6)略 过量
27.(1)Cu Cu2O或M2O
(2)锥形瓶 变浑浊 略。
(3)使反应充分进行或增大反应物间接触面或加快反应速率
MO+CM+CO↑ MO+COM+CO2↑ CO2+C2CO↑
仍继续通氮气,直至反应管冷却
(4)排尽装置中的空气或氧气 否 因为一直通入氮气,b中溶液不会倒吸到a管中 是
(5)740g
(6)氧化铜和铜 5: 32