- 649.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第七章 化学反应速率 化学平衡测试卷
满分100分,考试时间90分钟
试卷说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。请将第Ⅰ卷的答案填涂在答题卡上,第Ⅱ卷可在各题后直接作答。
本卷可能用到的相对原子质量:Mg—24 Al—27 Si—28 S—32 Ba—137 Ag—108 Fe—56 Cu—64 Cl—35.5 Br—80
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
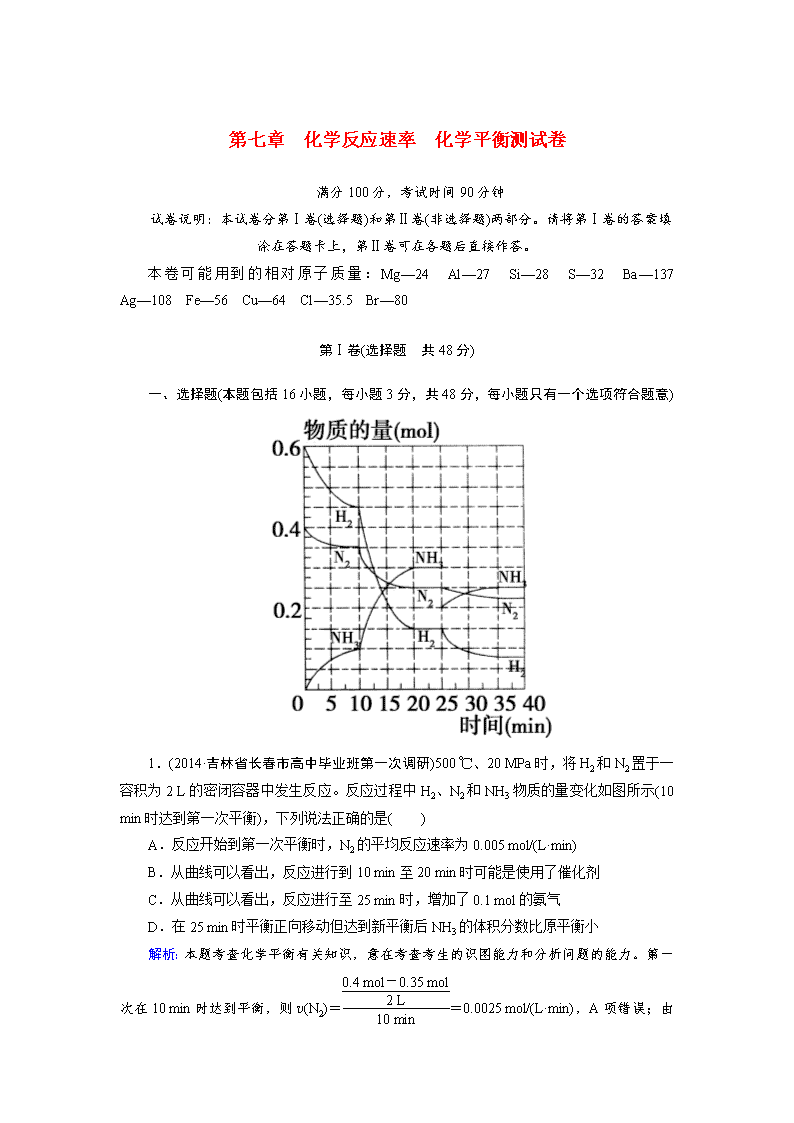
1.(2014·吉林省长春市高中毕业班第一次调研)500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( )
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
解析:
本题考查化学平衡有关知识,意在考查考生的识图能力和分析问题的能力。第一次在10 min时达到平衡,则v(N2)==0.0025 mol/(L·min),A项错误;由于10 min到20 min时,N2和H2继续减少,氨气继续增加,而催化剂不能使平衡发生移动,故B项错误;从图像可以看出,25 min时,NH3减少了0.1 mol,C项错误;25 min时,氨气的物质的量减少,故平衡正向移动,根据勒夏特列原理可知,再次达平衡时,氨气的体积分数比原平衡小,D项正确。
答案:D
2.(2014·湖北省武汉市部分学校高三调研)将2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)2C(g)+zD(g),若2分钟后达到平衡,A的转化率为50%,测得v(D)=0.25 mol/(L·min),则下列推断正确的是( )
A.v(C)=0.2 mol/(L·min)
B.z=3
C.B的转化率为25%
D.C的体积分数约为28.6%
解析:本题考查了化学平衡知识,意在考查考生的计算能力、判断能力。根据题给条件A的转化率为50%知,反应的A为1 mol,则生成的C为1 mol,由D的速率求出生成的D的物质的量为1 mol,所以C和D的化学计量数相同,即z=2,B错误;由速率之比等于化学计量数之比知,v(C)=0.25 mol/(L·min),A错误;反应的B为1.5 mol,B的转化率为75%,C错误。
答案:D
3.(2014·安微省皖南八校高三第二次联考)相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2NH3(g)N2(g)+3H2(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质
物质的量/mol
平衡时反应中的能量变化
NH3
N2
H2
①
2
0
0
吸收热量a kJ
②
0
1
3
放出热量b kJ
③
4
0
0
吸收热量c kJ
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
解析:本题考查了化学平衡知识,意在考查考生对平衡常数、体积分数以及平衡状态的理解和计算能力。若反应①中NH3的平衡转化率为50%,则a=b,若反应①中NH3的平衡转化率小于50%,则ab,A选项错误;温度相同,所以反应①、②、③的平衡常数相同,B选项错误;反应③可以看成是在两个相同容器中相同条件下同时进行反应①,达平衡后,把这两个容器中的气体压缩到其中一个容器中,如果平衡不移动,氢气的体积分数应该与反应①相等,但是压强增大,平衡向逆反应方向移动,氢气的体积分数减小,所以达平衡时氢气的体积分数:①>③,C选项正确;因为气体总质量始终不变,容器恒容,所以密度始终不变,不能用密度变化来衡量反应是否达到平衡,D选项错误。
答案:C
4.(2014·东北三校第一次联合模拟)一定温度下,在容积为1 L的密闭容器中,存在如下关系:xH2O(g)(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是( )
A.x=3
B.该温度下,反应的平衡常数为0.125 L2/mol2
C.平衡时混合气体的平均摩尔质量是33.3 g/mol
D.t1时刻,保持温度不变,再充入1 mol H2O(g),重新达到平衡时,将增大
解析:本题以化学平衡图像为载体考查化学平衡的移动、化学平衡常数以及化学平衡的计算,意在考查考生的分析能力和判断能力。根据图像可得如下关系:
xH2O(g) (H2O)x(g)
起始 5 mol 0 mol
转化 3 mol 1 mol
平衡 2 mol 1 mol
化学方程式中的化学计量数之比等于参加反应各物质的物质的量之比,则x=3,A项正确;该温度下反应的平衡常数K==0.125 L2/mol2,B项正确;平衡时混合气体的平均摩尔质量==30 g/mol,C项错误;t1
时刻,保持温度不变,再充入1 mol水蒸气,相当于增大压强,平衡右移,重新达到平衡时,将增大,D项正确。
答案:C
5.(2014·北京市海淀区高三年级第一学期期中)已知反应X(g)+Y(g)nZ(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
A.反应方程式中n=1
B.10 min时,曲线发生变化的原因是升高温度
C. 10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
解析:本题考查了化学反应速率的影响因素与化学平衡图像,意在考查考生对化学图像的分析能力。由图像可以看出,0~5 min,X的浓度减小了0.4 mol·L-1,而Z的浓度增大了0.4 mol·L-1,说明X与Z的化学计量数之比为11,故n=1,A项正确,10 min时,X、Y、Z的浓度同时增大一倍,且随后平衡正向移动,说明改变的条件为增大压强,B项错误,C项正确;0~5 min内,v(X)==0.08 mol·L-1·min-1,D项正确。
答案:B
6.(2014·陕西省长安一中高三第二次质检)用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:(a)<(c) (b)>(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
解析:本题考查了化学反应速率和化学平衡知识,意在考查考生对图像的观察能力和理解能力以及对信息的挖掘能力。由图可知,a、c两点压强相等,a点CO的平衡转化率较高,而该反应为放热反应,故温度T1K(c),平衡常数只与温度有关,b、d两点温度相等,平衡常数也相等,即K(b)=K(d),A选项正确;已推知T1v(d),B选项错误;CO的平衡转化率越大,n总越小,由=m/n总可知,n总(a)(c),(b)>(d),C选项错误;根据题意可知平衡时a点n(CO):n(H2)不一定等于1:2,D选项错误。
答案:A
7.(2014·辽宁省知名重点中学高三年级联考)在恒容的密闭容器中,可逆反应X(s)+3Y(g)2Z(g) ΔH>0,达到平衡时,下列说法正确的是( )
A.充入少量He使容器内压强增大,平衡向正反应方向移动
B.升高温度,平衡向正反应方向移动,容器内压强减小
C.继续加入少量X,X的转化率减小,Y的转化率增大
D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小
解析:本题考查了平衡移动、转化率等,意在考查考生的分析能力及解决实际问题的能力。在恒容的密闭容器中,充入少量He,容器内压强增大,但反应物浓度和生成物浓度都没有改变,平衡不移动,A项错误;升高温度,平衡向正反应方向移动,X(s)有可能气化,容器内压强不一定减小,B项错误;继续加入少量固体X,平衡不移动,Y的转化率不变,C项错误;继续加入少量Y,相当于在原平衡的基础上增大压强,平衡正向移动,再次平衡时,Y的体积分数比上次平衡小,D项正确。
答案:D
8.(2014·浙江省杭州市高三上学期期中七校联考)一定温度下,1 mol X和n mol Y在体积为2 L的密闭容器中发生如下反应:X(g)+Y(g)2Z(g)+M(s),5 min后达到平衡,此时生成2a mol Z。下列说法正确的是( )
A.用X表示5 min内此反应的反应速率是(0.1-0.2a) mol·(L·min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1 mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1 mol X,v(正)增大,v(逆)减小,平衡正向移动
答案:B
9.(2014·江苏省苏州市高新区第一中学高三模拟)温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法正确的是( )
A.反应在前10 min的平均反应速率v(B)=0.1 mol·L-1·min-1
B.该反应的平衡常数表达式K=
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15 min时,改变的条件是降低温度
答案:D
10.(2014·河北省保定市高三摸底)升高温度,下列数据可能减小的是( )
A.化学反应速率v
B.水的离子积常数Kw
C.化学平衡常数K
D.弱酸的电离平衡常数K
答案:C
11.(2014·江西省南昌市高三零模调研)在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1100 ℃时该反应平衡常数为1.64
D.压强为p4时,在y点:v正>v逆
解析:本题考查了化学平衡,意在考查考生对化学平衡移动原理的理解及计算能力。由图像可知,压强一定时,温度越高,甲烷的平衡转化率越高,故正反应为吸热反应,ΔH>0,A项错误;该反应为气体分子数增加的反应,压强越高,甲烷的平衡转化率越小,故压强p4>p3>p2>p1,B项正确;1100 ℃时,甲烷的平衡转化率为80.00%,故平衡时各物质的浓度分别为c(CH4)=0.02 mol/L,c(CO2)=0.02 mol,c(CO)=0.16 mol/L,c(H2)=0.16 mol/L,即平衡常数K==1.64,C项正确;压强为p4时,y点未达到平衡,此时v正>v逆,D项正确。
答案:A
12.(2014·浙江省名校新高考研究联盟第一次联考)已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)2SO3(g)
ΔH1=-197 kJ·mol-1 K1=a
(2)2NO(g)+O2(g)2NO2(g)
ΔH2=-144 kJ·mol-1 K2=b
(3)NO2(g)+SO2(g)SO3(g)+NO(g)
ΔH3=-m kJ·mol-1 K3 =c
下列说法正确的是( )
A.m=53 c2=a/b B.m=-26.5 2c=a-b
C.m=-170.5 2c=a-b D.m=26.5 c2=a/b
解析:本题考查了盖斯定律的运用,意在考查考生对相关知识的掌握情况。根据盖斯定律,由(1)-(2)得2NO2(g)+2SO2(g)===2SO3(g)+2NO(g) ΔH=-53.0 kJ·mol-1,所以NO2
(g)+SO2(g)===SO3(g)+NO(g) ΔH=-26.5 kJ·mol-1,故m=26.5,K=K1/K2,即c2=a/b,D项正确。
答案:D
13.(2014·四川省成都市高中毕业班诊断)已知(HF)2(g)2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
A.温度:T1va
D.当=30 g/mol时,n(HF):n[(HF)2]=2:1
解析:本题考查化学平衡移动及其影响因素,意在考查考生对化学平衡移动原理的掌握情况。由题给信息知该反应为气体分子数增大的吸热反应,从图像可以看出,当压强不变时,由T1到T2,增大,说明n总减小,平衡左移,即平衡向放热反应方向移动,所以由T1到T2为降低温度的过程,即T1>T2,A项错误;由于T1温度较高,升高温度平衡右移,故温度为T1时的平衡常数大于温度为T1时的平衡常数,再结合温度不变平衡常数不变知,K(b)>K(a)=K(c),B项错误;温度越高,反应速率越大,压强越大,反应速率越大,故vb>va,C项正确;设HF为x mol,(HF)2为y mol,当=30 g/mol时,有=30,解得x=y,即n(HF):n[(HF)2]=1:1,D项错误。
答案:C
14.(2014·山东省潍坊市高三联考)一定条件下反应2AB(g)A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内三种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
解析:本题考查了化学平衡状态的判断,意在考查考生对化学平衡原理的理解能力。任何时刻,生成n mol A2,必然消耗2n mol AB,A项错误;可逆反应中任何时刻,反应物与生成物均共存,B项错误;达到平衡时,AB的消耗速率与A2的消耗速率之比等于化学方程式中的计量数之比,C项错误;达到平衡后,反应物和生成物的浓度不再变化,各组分的体积分数不再变化,D项正确。
答案:D
15.(2014·河北省唐山市高三统考)等物质的量的A(g)与B(g)在密闭容器中进行反应:A(g)+B(g)2C(g)+D(s) ΔH<0,下列叙述正确的是( )
A.达到平衡后,反应速率v正(A)=2v逆(C)
B.达到平衡后,增大压强,平衡逆向移动
C.达到平衡后,升高温度,平衡正向移动
D.平衡常数K值越大,A的转化率越高
解析:本题考查了化学平衡知识,意在考查考生对化学平衡知识的理解和运用能力。根据反应速率之比应等于化学计量数之比可知,2v正(A)=v逆(C)时反应达到平衡,A选项错误;这是一个反应前后气体分子数不变的反应,改变压强,平衡不移动,B选项错误;该反应的正反应为放热反应,升高温度,平衡向吸热的反应方向移动,即逆向移动,C选项错误;平衡常数K值越大,说明平衡正向进行的程度越大,A的转化率越高,D选项正确。
答案:D
16.(2014·辽宁省五校协作体高三期末联考)将2 mol A和1 mol B充入V升的密闭容器中,在一定条件下发生反应:2A(g)+B(g)2C(g)。平衡时C的体积分数(%)随温度和压强的变化如下表所示:
下列判断正确的是( )
A.b>e
B.415 ℃、2.0MPa时B的转化率为60%
C.该反应的ΔH>0
D.平衡常数K(550 ℃)>K(350 ℃)
答案:A
第Ⅱ卷(非选择题 共52分)
二、非选择题
17.(2014·吉林省长春市高中毕业班第一次调研)(12分)已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃
400
500
850
平衡常数
9.94
9
1
请回答下列问题:
(1)上述反应的化学平衡常数表达式为:________________。该反应的Q________________0(填“>”或“<”)。
(2)850 ℃时在体积为10 L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=________。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020 mol/L,该条件下,CO的最大转化率为________________。
(4)若在850 ℃时进行,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________________。
(5)某电化学装置可实现2CO2===2CO+O2的转化,使CO重复使用。已知该反应的阳极反应为4OH--4e-===2H2O+O2↑,则阴极反应式为________________。
(6)有人提出可以设计反应2CO===2C+O2(ΔH>0)来消除CO的污染。请判断上述反应能否自发进行:________________(填“可能”或“不可能”),理由是________________。
解析:本题考查化学反应速率和化学平衡,意在考查考生解决化学问题的能力。(1)可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=。由表中数据可知,温度越高,平衡常数越小,平衡向逆反应方向移动,因升高温度平衡向吸热方向移动,故正反应为放热反应。(2)由图像可知:CO在4 min内浓度减小了0.20 mol/L-0.08 mol/L=0.12 mol/L,则v(CO)==0.03 mol/(L·min)。(3)500 ℃时平衡常数为9,设CO最多能转化x mol/L,则
CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol/L): 0.02 0.02 0 0
转化(mol/L): x x x x
平衡(mol/L): 0.02-x 0.02-x x x
则有:=9,解得x=0.015,则CO的最大转化率为×100%=75%。(4)850 ℃时平衡常数为1,有
CO(g) + H2O(g)CO2(g)+H2(g)
1-x x 0 0
y(1-x) y(1-x) y(1-x) y(1-x)
1-x-y+xy x-y+xy y(1-x) y(1-x)
则有:=1,解得y=x。(5)由于阴极发生还原反应,CO2被还原生成CO,则阴极反应为:2CO2+4e-+2H2O===2CO+4OH-。(6)由于反应2CO===2C+O2的ΔH>0,ΔS<0,则ΔG=ΔH-TΔS>0,反应是一个焓增、熵减的反应,任何情况下都不能自发进行。
答案:(1)K==(1分) <(1分)
(2)0.03 mol/(L·min) (2分)
(3)75%(2分) (4)y=x(2分)
(5)2CO2+4e-+2H2O===2CO+4OH-(2分)
(6)不可能(1分) ΔH>0吸热且ΔS<0(或依据吉布斯自由能判断)(1分)
18.(2014·河南省洛阳市高三年级统考)(10分)化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
解析:(1)固体不写入平衡常数表达式中。①观察图像可知t2时逆反应速率突然增大,并且平衡逆向移动,所以改变的条件可能是增大压强或增大生成物浓度。该反应是吸热反应,升高温度平衡正向移动,而加入催化剂对平衡移动无影响,所以不可能是升高温度或使用催化剂。②若t4时降压,正、逆反应速率突然减小,平衡正向移动,正反应速率大于逆反应速率,在趋于平衡的过程中逆反应速率逐渐增大,平衡时与t6时v(逆)相等。(2)①反应器中发生反应的化学方程式为I2+SO2+2H2O===H2SO4+2HI,改写成离子方程式即可。②该循环工艺的目的之一是制备氢气,而HI分解生成H2与I2(g)的反应是可逆反应,为了增大H2的产率,使平衡正向移动,需要不断地分离出氢气。
答案:(1)c(CO)·c(H2)/c(H2O)(2分)
①增大压强或增大生成物浓度(2分)
②
(2)①SO2+I2+2H2O===4H++SO+2I-(2分)
②降低生成物的浓度,使平衡正向移动(2分)
19.(2014·浙江省名校新高考研究联盟第一次联考)(8分)某可逆反应X(g)+Y(g)Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
T/℃
700
800
850
1000
K
0.01
0.05
0.10
0.40
(1)上述反应的平衡常数表达式K=________,ΔH________0(填“>”或“<”)。加入催化剂,该反应的ΔH将________(填“增大”、“减小”或“不变”)。
(2)若上述反应在绝热恒容的密闭容器内进行,则能说明该反应达到化学平衡状态的依据有________。
A.混合气体的密度保持不变
B.v正(X)=v正(Z)
C.容器内温度恒定
D.W的质量分数不变
(3)在850 ℃、体积为1 L的密闭容器内,加入0.2 mol Z和0.3 mol W发生上述反应。X的c(X)-t曲线如图所示。
①0~4 min内W的平均速率为________mol·L-1·min-1。
②在5 min末将容器体积缩小至0.5 L,若在8
min末达到新平衡(此时X的浓度约为0.26 mol/L),请在图中画出5 min~9 min的X浓度的变化曲线。
解析:本题考查了反应热、化学反应速率与化学平衡知识,意在考查考生对化学反应原理的综合运用能力。(1)根据化学平衡常数的含义可写出该反应的K=,由表中数据得出,随着温度的升高,K增大,说明反应正向进行,故正反应为吸热反应,即ΔH>0。ΔH与化学反应的起始状态、终止状态有关,与物质所处环境的温度、压强有关,与化学反应的过程无关,故使用催化剂时ΔH不变。(2)因反应前后均是气体,且容器体积不变,故密度始终不变,A项不符合题意;B项表示的都是正反应速率,B项不符合题意;容器内温度恒定,说明热量不会改变了,反应达到平衡,C项符合题意;W的质量分数不变,说明反应达到平衡,D项符合题意。(3)①从图中可以得出,0~4 min X的浓度改变了0.10 mol·L-1,则v(X)=0.10 mol·L-1÷4 min=0.025 mol·L-1·min-1,又v(X):v(W)=1:2,故v(W)=0.05 mol·L-1·min-1。②因5 min末将容器体积缩小到0.5 L,各物质的浓度增大1倍,达到新平衡时,8 min时X的浓度为0.26 mol·L-1,可得出平衡点为(8,0.26),从而画出图线。
答案:
(1)(1分) >(1分) 不变(1分)
(2)CD(1分)
(3)①0.05(1分) ②如图所示[起点:(5,0.20)→平衡点:(8,0.26)](2分)
20.(2014·山西省高三年级第二次四校联考)(8分)如图所示的装置中发生反应2A2(g)+B2(g)2C(g) ΔH=-a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2 mol A2和1 mol B2,两容器分别在500 ℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为________________;若将温度升高到700 ℃,反应的平衡常数将________(填“增大”、“减小”或“不变”)。
(2)比较大小:w1________w2(填“>”、“=”或“<”),a、b、c由大到小的关系为________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将________
(填“增大”、“减小”或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500 ℃时达平衡后C的浓度为w3 mol/L,则w1、w3的关系为_________。
(5)能说明A中已达到平衡状态的是________________(填序号,有一个或多个选项符合题意)。
a.v(C)=2v(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出C气体
b.适当升高温度
c.增大B2的浓度
d.选择高效的催化剂
解析:本题考查了化学反应速率和化学平衡知识,意在考查考生对相关知识的理解与应用能力。(1)根据化学方程式可写出反应的平衡常数表达式。平衡常数只与温度有关,该反应为放热反应,升高温度,平衡逆向移动,平衡常数将减小。(2)A容器处于恒容状态,B容器处于恒压状态,该反应为气体分子数减小的反应,达到平衡时,B容器的体积小于A容器的体积,B容器相对于A容器相当于增压,平衡正向移动,w1b,由于该反应为可逆反应,不能进行完全,所以a>c>b。(3)若打开K,一段时间后重新达平衡,容器B的体积将减小,压强与外界压强相同。(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,不考虑平衡移动,则在500 ℃时达平衡后,C的浓度为2w1 mol/L,由于压强增大,平衡正向移动,所以w3>2w1。(5)任何时候,反应中均有v(C)=2v(B2)。因为该反应是一个反应前后气体分子数不相等的反应,所以容器内气体压强保持不变时已达到平衡状态,容器中气体的平均相对分子质量不随时间而变化时已达到平衡状态。反应中生成物和反应物均为气态,又容器恒容,任何时候密度均不变。(6)分离出C气体,反应速率减小,平衡向正反应方向移动;适当升高温度,反应速率增大,平衡向逆反应方向移动;增加B2的浓度,反应速率增大,平衡向正反应方向移动;选择高效的催化剂,反应速率增大,但平衡不移动。
答案:(每空1分)(1)K= 减小
(2)< a>c>b (3)减小
(4)w3>2w1
(5)bc (6)c
21.(2014·北京市海淀区高三第一学期期中)(14分)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度/℃
360
440
520
K值
0.036
0.010
0.0038
(1)①写出工业合成氨的化学方程式:________________。
②由表中数据可知该反应为放热反应,理由是________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是______
(填字母序号)。
a.增大压强
b.使用合适的催化剂
c.升高温度
d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)CO2(g)+H2(g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
,则平衡时CO的转化率为________该温度下反应的平衡常数K值为________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是________________(填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO)n(H2O)n(CO2)n(H2)=11666
解析:本题考查了化学平衡及其移动、化学平衡常数的有关计算及其应用等,意在考查考生运用所学知识综合分析、解决问题的能力。(1)③合成氨反应为气体分子数减小的反应,故增大压强时平衡正向移动,a对;催化剂不能改变反应的限度,b错;合成氨反应为放热反应,升高温度平衡逆向移动,c错;及时分离出产物,减小了生成物的浓度,有利于反应正向进行,d对。(2)①在p2压强下的曲线上任意一点向下作垂线,由此看出相同温度时,压强为p1时甲烷平衡含量小,说明p1时反应限度大,而该反应为气体分子数增大的反应,故p1