- 929.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
全国名校高三化学调研试卷(无机推断题)精选汇编
1.( 14 分)下图是无机物A~N在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。N中只含有两种元素,N可作为工业生产C的原料。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第__________周期_______族。
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。
(3)反应⑩的离子方程式是:_______ ______。
(4)反应④ 的离子方程式是:___________________________________。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是:
________________________________________________________________(6)现有1molN参加反应,假设各步反应均完全,生成C的质量为490g,生成G的质量为224g,则反应①的化学方程式为_______________________。
1.( 14 分) ( l )四(或4 ) VIII (共1分,错一个扣1分)
( 2 )③ (1分)
( 3 ) 3Fe +2 NO3- + 8H+ + = 3Fe2+ + 2NO↑+4H2O (3分)
( 4 ) 3Fe2+ + NO3- + 4H+ + = 3Fe3+ + NO↑+2H2O (3分)
( 5 ) Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O (3分)
(6)Fe4S5+8O22Fe2O3+5SO2(3分)
2.(10分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做致冷剂。
(1)写出化学式F ,写出电子式G ;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
2.答案:(10分)(1)NH3、; (共2分)
(2)取少量G的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热 用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色(2分)
(3)2OH-+Cl2=ClO-+Cl-+H2O (2分) 8NH3+3Cl2N2+6NH4Cl (2分)
(4) (2分)
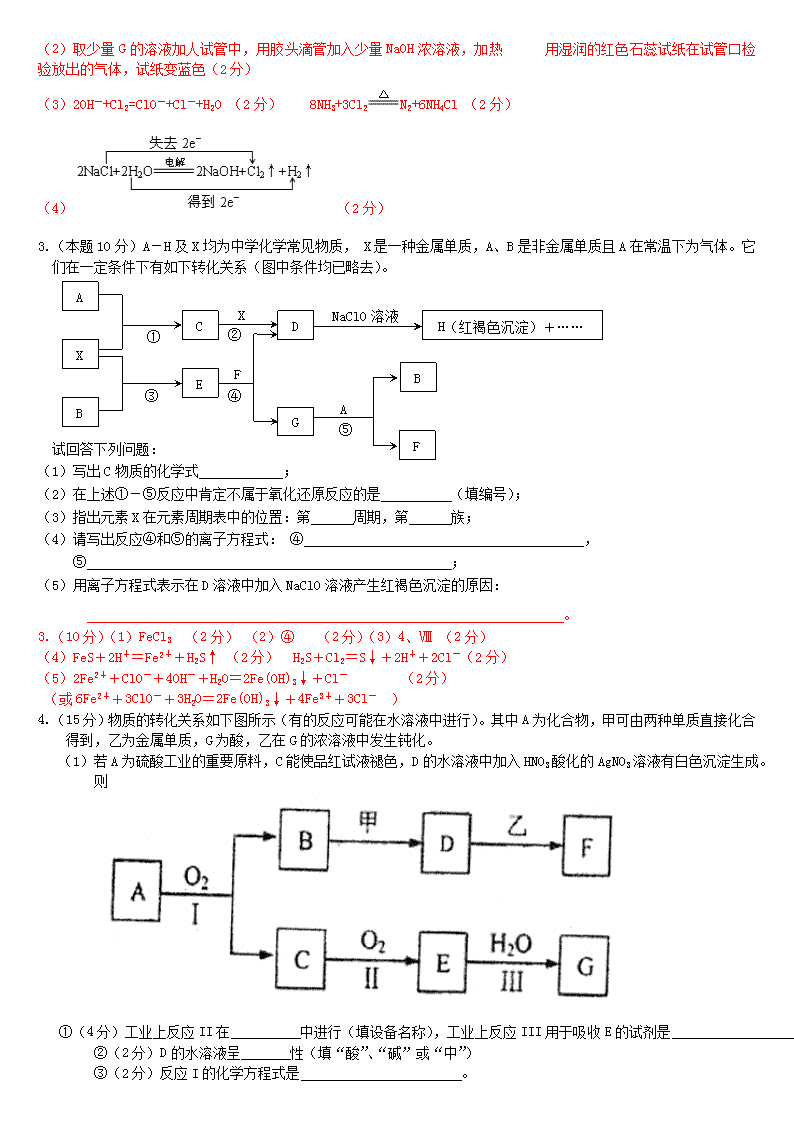
3.(本题10分)A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
A
X
B
C
D
H(红褐色沉淀)+……
E
G
B
F
F
A
NaClO溶液
①
②
③
④
⑤
X
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置:第 周期,第 族;
(4)请写出反应④和⑤的离子方程式: ④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。
3.(10分)(1)FeCl3 (2分) (2)④ (2分)(3)4、Ⅷ (2分)
(4)FeS+2H+=Fe2++H2S↑ (2分) H2S+Cl2=S↓+2H++2Cl-(2分)
(5)2Fe2++ClO-+4OH-+H2O=2Fe(OH)3↓+Cl- (2分)
(或6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- )
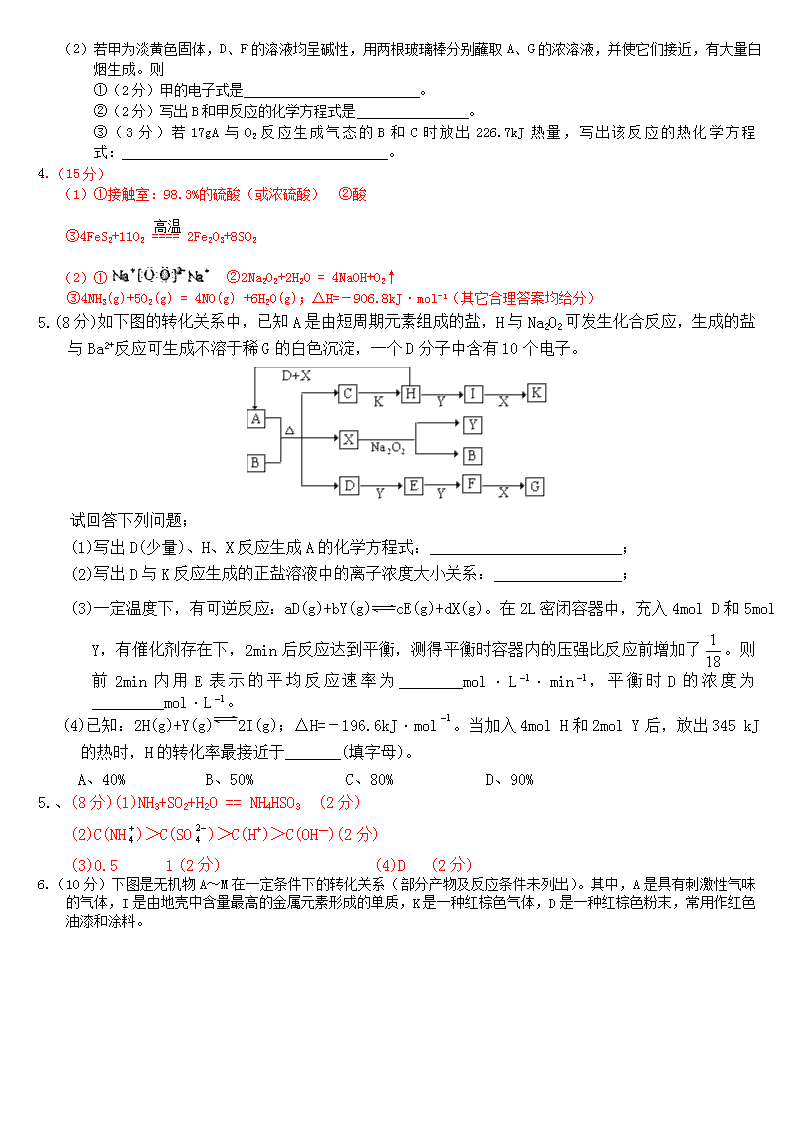
4.(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。
(1)若A为硫酸工业的重要原料,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①(4分)工业上反应II在 中进行(填设备名称),工业上反应III用于吸收E的试剂是 。
②(2分)D的水溶液呈 性(填“酸”、“碱”或“中”)
③(2分)反应I的化学方程式是 。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液,并使它们接近,有大量白烟生成。则
①(2分)甲的电子式是 。
②(2分)写出B和甲反应的化学方程式是 。
③(3分)若17gA与O2反应生成气态的B和C时放出226.7kJ热量,写出该反应的热化学方程式: 。
4.(15分)
20081020
(1)①接触室:98.3%的硫酸(或浓硫酸) ②酸
高温
③4FeS2+11O2 ==== 2Fe2O3+8SO2
(2)① ②2Na2O2+2H2O = 4NaOH+O2↑
③4NH3(g)+5O2(g) = 4NO(g) +6H2O(g);△H=-906.8kJ·mol-1(其它合理答案均给分)
5.(8分)如下图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题;
(1)写出D(少量)、H、X反应生成A的化学方程式:________________________;
(2)写出D与K反应生成的正盐溶液中的离子浓度大小关系:________________;
(3)一定温度下,有可逆反应:aD(g)+bY(g)cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了。则前2min内用E表示的平均反应速率为________mol·L·min,平衡时D的浓度为_________mol·L。
(4)已知:2H(g)+Y(g)2I(g);△H=-196.6kJ·mol。当加入4mol H和2mol Y后,放出345 kJ的热时,H的转化率最接近于_______(填字母)。
A、40% B、50% C、80% D、90%
5.、(8分)(1)NH3+SO2+H2O == NH4HSO3 (2分)
(2)C(NH)>C(SO)>C(H+)>C(OH-)(2分)
(3)0.5 1 (2分) (4)D (2分)
6.(10分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_______(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:___________________
6.⑴四 Ⅷ
⑵2:1
⑶②⑧
⑷3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑+ 2H2O
⑸Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
7.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
Y
A
氯气
D溶液
C
X
D无水晶体
E
F
G
H
A
B溶液
G
原电池
反应
+氧气⑥
+Y高温⑦
①
②
③
电解
熔融
操作a
+氧气
+氧气
+C
⑤
△
④
浓溶液
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为
7.(1)2Mg+CO2===2MgO+C; (2分) (2)将D溶液在HCl气流中蒸干;(2分)
(3)②4NH3+5O2 4NO+6H2O; (2分)
(4)⑤C+4HNO3(浓)CO2↑+4NO2↑+2H2O (2分)
(5)2NH4++2e- = 2NH3↑+H2↑ (2分)
8.下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
8. ⑴Na+[]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2OFe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
9、(10分)物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1:2,A、E、J、N中含有同一种元素。
回答下列问题:
⑴X的化学式为_______________,O的结构简式为____________________,其中属于置换反应的是______________(填序号)。
⑵考虑到综合经济效益,工业生产M时,可采取的措施有_______________(填序号)。
⑶写出反应⑦的化学方程式________________________________________________。
a.使用催化剂 b.适当降低温度 c.选择合适的温度 d.适度增大压强 e.及时分离出产物 f.对原料进行循环利用 g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市 i.工厂地址可选择在盛产天然气的地区
设备Ⅰ的名称_______________。工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是____________(填序号)。
⑶现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为_______________________________________________。
9.⑴H2O2 ② ⑵acdefgi 合成塔 ⑥
⑶Fe4S5+8O22Fe2O3+5SO2 ⑶CO2+2NH3CO(NH2)2+H2O
10. 下图为中学化学常见物质间的转化关系。其中B、F为无色气体, E为黑色固体,I为红色沉淀, J、K、B为单质,J、B的组成元素在周期表中位于同一主族,L与M的摩尔质量相同,M、N的焰色反应黄色。
过量的
N溶液
点燃
点燃
A的溶液
B
D
C
E
A
F
P
G
I
H
D
J
N
B
D
B
H2O
B
K
M
L
H2O
B
加热
条件1
有机物1
根据以上转化回答下列问题:
(1)转化关系图中条件1是 ,有机物1 必须具有的官能团的名称是 I的名称是
(2)C与D的浓溶液反应的化学方程式是
(3)写出N的溶液与过量的F反应的离子方程式
(4)F到H的反应是放热反应,工业生产中完成这一转化的条件是
常压,400℃~500℃,催化剂,选用这一条件的理由是
在此条件下,若要提高F的转化率,你认为还可采用的措施是
参考答案:
10、(1)用惰性电极通电电解;醛基;氧化亚铜
(2)Cu+2H2SO4(浓)=CuSO4+2H2O+SO2
(3)OH-+ SO2=SHO3-
(4)略
11.(8分)已知X、Y、Z为三种由短周期元素构成的粒子,每mol粒子都有10mol电子,其结构特点如下:
X
Y
Z
原子核数
单核
四核
双核
粒子的电荷数
1个单位正电荷
0
1个单位负电荷
物质A由X、Z构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请回答下列问题:
(1)A的化学式为 ;D的结构式为 。
(2)完成下列反应的离子方程式:
反应① 。
反应④ 。
(3) 若J气体浓度过高可导致高铁血红蛋白血症,且污染大气等。但J也有不少的用途,如
(举出一例)
11.(共8分)
(1) A: NaOH (1分) D: N ≡ N (1分)
通电
(2) 反应①: Cl2 + 2OH- == Cl- + ClO- + H2O(2分)
反应④: 2Cl- +2 H2O == 2OH- + Cl2↑ + H2↑(2分)
(3) 作为一种信使参与炎症反应、信号传递、血管调节及免疫调节等(只要答案合理均可得分)。(2分)
加热
Y溶液
G↑
④+NaOH溶液
D↑
E↑
高温
水
F
⑤+D
G↑
D↑
J↑
J↑
②
O2↑
M
R
E↑
①
B
C
A↑
1400~1800℃
冰晶石
1000℃熔融电解
⑧+E↑
高温、催化剂
⑥+水
高温高压催化剂
⑦
适宜
条件
③+水
12.(10分)下图涉及多种无机化工反应,其中R是一种新型无机材料,M是一种应用广泛的金属材料,F是人工合成的第一种有机物,且是一种常见的化学肥料,A、C、D、M均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O中G与J的最佳配比为2∶1,向Y溶液中通入足量的J气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到B。
⑴试写出下列指定物质的化学式:B_________________,F_____________。
⑵反应①的化学方程式为___________________________________________。
⑶反应④的离子方程式为___________________________________________。
⑷上述反应中属于非氧化还原反应的有_____________(填写相应反应的序号)。
12.⑴Al2O3(2分) CO(NH2)2(2分)
⑵N2+Al2O3+3C 1400~1800℃
3CO+2AlN(2分)
⑶AlN+OH-+H2O=AlO+NH3↑(2分)
⑷④⑦(2分,少一个正确答案扣1分、错选一个倒扣一分扣完为止)
13.物质之间的转化关系如下图所示,A(只含两种元素)可作为工业生产J的原料,B、C、H、I为非金属单质,X的水溶液为一种常见的无色医用消毒液,F为常见的红棕色防锈油漆颜料的主要成分,O是常见氮肥,且反应⑦中L与M的物质的量之比为1∶2,A、E、J、N中含有同一种元素。
回答下列问题:
⑴X的化学式为_______________,C+D的反应方程式为____ ______________ _
⑵考虑到综合经济效益,工业生产M时,可采取的措施有_______________(填字母序号)。
a.使用催化剂 b.适当降低温度 c.选择合适的温度 d.适度增大压强 e.及时分离出产物 f.对原料进行循环利用 g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市 i.工厂地址可选择在盛产天然气的地区;
设备Ⅰ的名称是_______________。工业生产中为了节约资源、降低成本和保护环境,
常对某些物质进行循环利用。上述转化关系中能达到该目的的是___________(填数字序号)。
⑶写出反应⑦的化学方程式________________________________________________。
⑷现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①
的化学方程式为_________________________________________。
13.(12分)
(1)H2O2(2分),C+H2OCO+H2 (2分);
(2)acdefgi (2分), 合成塔 (1分), ⑥ (1分);
(3)CO2+2NH3CO(NH2)2+H2O (2分);
(4)Fe4S5+8O22Fe2O3+5SO2(2分)。
14.(08宁夏卷)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ 。
(2)写出①处发生反应的离子方程式 。写出③处发生反应的化学方程式 。
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
答案:(1)①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠。
(2)Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+。
Cu2++Fe=Cu+Fe2+ ;2Au3++3Fe=2Au+3Fe2+。
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3;用作红色涂料;用作制造铜盐的原料。
15.(08江苏卷)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
答案:⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I— == 2Fe2+ + I2
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
16.(08海南卷)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
__________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
解析:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64∶80=4∶5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S。E为H2SO3。
答案:(1)H2+SH2S(写成可逆反应也正确)。
(2)H2SO3 + 2H2S=3S + 3H2O。
(3)C+2H2SO4(浓)CO2 ↑+2SO2 ↑+2H2O或Cu+ 2H2SO4(浓)CuSO4 +SO2 ↑+ 2H2O等。
(4)①H2SO3 +2OH— = SO32— + 2H2O。
②大于;Na2SO3溶液中SO32-发生水解使溶液显碱性。
③增大;升高温度促进Na2SO3溶液的水解。
17.(08全国Ⅰ卷)V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成,上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:
(1)5种化合物分别是V 、W 、X 、Y 、Z 。(填化学式)
(2)由上述5种化合物中2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是 。
(3)V的电子式是 。
解析:此题的关键V由两种元素组成,且V+H2OY(白色固体)+Z(无色气体),在中学阶段常见的有Na2O2、Mg3N2、CaC2,很明显Na2O2不满足V+O2W(白色固体)+X(无色气体),若为Mg3N2,则Y为Mg(OH)2,Z为NH3,X可能为NO,W为MgO,所有的原子序数的总和为28,与题意不符;若为CaC2,则Y为Ca(OH)2,根据Y逆推W为CaO,Z为C2H2,X为CO2,其中C、H、O、Ca的原子序数的总和为36,与题意符合。
答案:(1)CaC2;CaO;CO2;Ca(OH)2;C2H2。
(2)Ca(OH)2+2CO2===Ca(HCO3)2。Ca
2+
C
C
2-
(3) 。
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1 3
18.(08北京卷)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+===I2+Z+H2O藏作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)___________。
a、同位素 b、同系物 c、同素异形体 d、同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_____________________________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
______________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是____________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_________________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m∶n=__________________(用含w1、w2、和a的代数式表示)。
【解析】X的组成元素是第三周期原子半径最小的元素,为:Cl2,根据反应式:Y+2I-+2H+=I2+Z+H2O,可知Y中必含有“O”,其为气体单质,只能是O3,故Z是O2,据此可知Y和Z是同素异形体;O3的漂白是利用其强氧化性,是不可逆的,而SO2的漂白具有可逆性,受热能恢复原色,故可以加热区分;证明Cl2比S的氧化性强,可以从其单质的置换,氧化变价金属呈现的价态不同等多方面体现;HCN的结构简式为:,KCN溶液呈碱性,是由于其中的CN-水解的缘故;足量的Z与盐完全反应生成CR2和MmRn,根据原子守恒,可知R为O,据此反应式可写为:
O2+MCO3= CO2+MmRn
w1 w2
44 1/m(am+16n),列比例式整理得:m:n=
【答案】
【高考考点】元素周期表、氧化还原性强弱的判断、物质结构、盐类水解等知识
【易错提醒】错误的进行有关计算。
【备考提示】本题属于推断题,考查了元素周期表的知识,要求熟练掌握元素周期表的知识,同时,对常见元素化合物的知识要熟练掌握,在此基础上,根据题目大胆猜测,仔细验证,即能得出正确答案。
9.(08北京卷)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填化学式)________________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是______________________________。
②若Z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是________________。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)________________。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol电子,该反应的离子方程式是_________________________________。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)__________________________。
【解析】根据题给物质,包括Fe2O3,Fe,CuO,C,Al,根据(1)中现象,可知不含Al,Y为亚铁盐溶液,固体为Cu和Fe;Z为一种气体时,浓酸为硫酸,其:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有CO2, 若是两种气体时,浓酸为硝酸,C+4HNO3=CO2↑+4NO2↑+2H2O,通过水后,气体为CO2和NO;向Y中通入过量氯气,生成的FeCl3逐渐与铁粉和铜粉反应生成CuCl2和FeCl3,溶液阳离子为Cu2+,Fe3+和H+;氯化亚铁溶液中加淀粉碘化钾和H2O2时,其反应为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;原样品中加足量稀硫酸,Y溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO和C或CuO、C和Fe2O3。
【答案】
【高考考点】元素化合物知识和有关计算、离子方程式的书写
【易错提醒】不能正确理解通入过量氯气对反应的影响,造成书写的离子不全,离子方程式书写错误。
【备考提示】探究性学习的方法及思维方式,是一种高考的发展方向之一。其往往采用对比的方法,根据实验中出现的不同现象进行合理的解释或阐述,以期展现思维的过程。希望同学们在复习备考中多注意训练,逐步培养自己科学的学习研究素养。
20.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __ _____________
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
晶胞
晶胞的
○:阳离子D+
●:阴离子EC6x-
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁 原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(10分)(1)⑴ (1分) 第二周期、第ⅦA族 (2分)
⑵ Na+ (1分)
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分) ⑷ Na3AlF6 (2分) (5) B C(2分,选1个且正确的给1分,错选一个该题0分,)