- 611.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
全国100所名校最新高考模拟示范卷·理科综合卷(四)
化学试卷
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Mn-55 Ga-70 As-75 Ag-108
一.选择题(本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。)
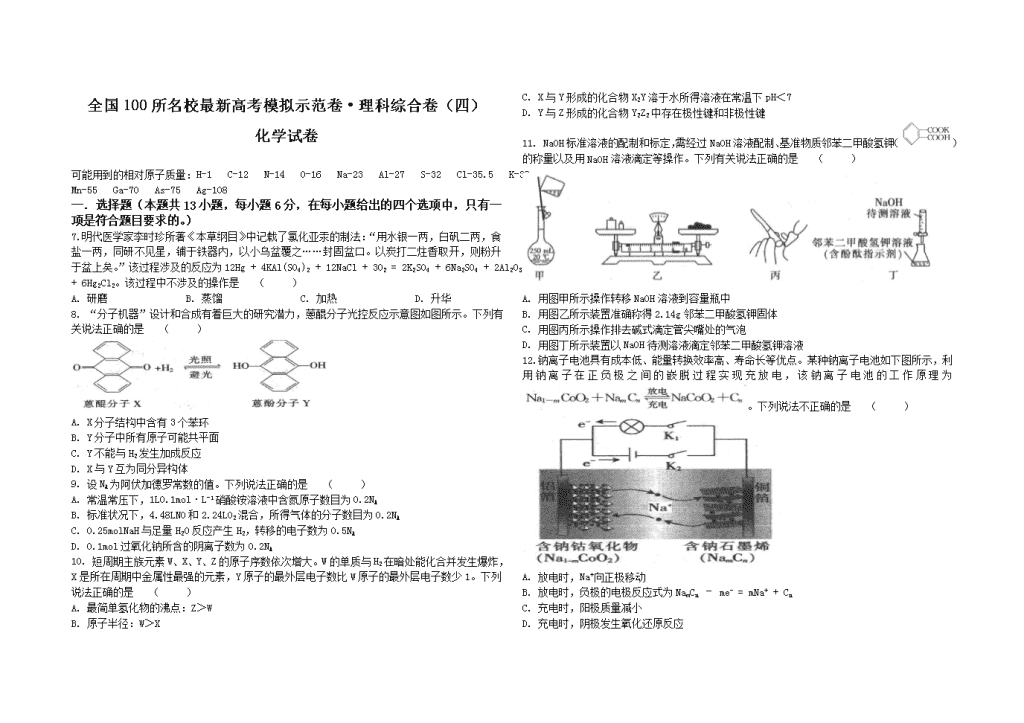
7. 明代医学家李时珍所著《本草纲目》中记载了氯化亚汞的制法:“用水银一两,白矾二两,食盐一两,同研不见星,铺于铁器内,以小乌盆覆之……封固盆口。以炭打二炷香取开,则粉升于盆上矣。”该过程涉及的反应为12Hg + 4KAl(SO4)2 + 12NaCl + 3O2 = 2K2SO4 + 6Na2SO4 + 2Al2O3 + 6Hg2Cl2。该过程中不涉及的操作是 ( )
A. 研磨 B. 蒸馏 C. 加热 D. 升华
8. “分子机器”设计和合成有着巨大的研究潜力,蒽醌分子光控反应示意图如图所示。下列有关说法正确的是 ( )
A. X分子结构中含有3个苯环
B. Y分子中所有原子可能共平面
C. Y不能与H2发生加成反应
D. X与Y互为同分异构体
9. 设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 常温常压下,1L0.1mol·L-1硝酸铵溶液中含氮原子数目为0.2NA
B. 标准状况下,4.48LNO和2.24LO2混合,所得气体的分子数目为0.2NA
C. 0.25molNaH与足量H2O反应产生H2,转移的电子数为0.5NA
D. 0.1mol过氧化钠所含的阴离子数为0.2NA
10. 短周期主族元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是所在周期中金属性最强的元素,Y原子的最外层电子数比W原子的最外层电子数少1。下列说法正确的是 ( )
A. 最简单氢化物的沸点:Z>W
B. 原子半径:W>X
C. X与Y形成的化合物X2Y溶于水所得溶液在常温下pH<7
D. Y与Z形成的化合物Y2Z2中存在极性键和非极性键
11. NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质邻苯二甲酸氢钾()的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是 ( )
A. 用图甲所示操作转移NaOH溶液到容量瓶中
B. 用图乙所示装置准确称得2.14g邻苯二甲酸氢钾固体
C. 用图丙所示操作排去碱式滴定管尖嘴处的气泡
D. 用图丁所示装置以NaOH待测溶液滴定邻苯二甲酸氢钾溶液
12. 钠离子电池具有成本低、能量转换效率高、寿命长等优点。某种钠离子电池如下图所示,利用钠离子在正负极之间的嵌脱过程实现充放电,该钠离子电池的工作原理为。下列说法不正确的是 ( )
A. 放电时,Na+向正极移动
B. 放电时,负极的电极反应式为NamCn – me- = mNa+ + Cn
C. 充电时,阳极质量减小
D. 充电时,阴极发生氧化还原反应
13. 向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀从而除去Cl-,降低对电解的影响,反应原理为Cu(s) + Cu2+(aq) + 2Cl-(aq) 2CuCl(s)。实验测得常温下电解液的pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是 ( )
A. 溶液pH越大,c(Cl-)越大
B. 向电解液中加入稀硫酸,有利于除去Cl-
C. 溶液呈中性时,c(Cl-)=0.02mol·L-1
D. 反应达到平衡时,增大c(Cu2+),c(Cl-)减小
三.非选择题(包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须作答。第33题~第38题为选考题,考生根据要求作答。)
(一)必考题(11题,共129分)
26.(14分)“低碳经济”备受关注,研究和深度开发CO2的应用对构建生态文明社会具有重要的意义。
(1)TiO2是一种性能优良的光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图1为在TiO2的催化下,O3降解HCHO(甲醛)的示意图。甲醛的电子式为 ,该反应的化学方程式为 。
(2)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应:CO2(g) + CH4(g) 2CO(g) + 2H2(g)。
①化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧的相关热化学方程式如下:
CH4(g) + NiO(s) = CO(g) + 2H2(g) + Ni(s) △H=+208.6kJ·mol-1
CH4(g) + 2NiO(s) = CO2(g) + 2H2(g) + 2Ni(s) △H=+169.9kJ·mol-1
则反应CO2(g) + CH4(g) 2CO(g) + 2H2(g)的△H= 。
②为了探究反应CO2(g) + CH4(g) 2CO(g) + 2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,并使二者物质的量浓度均为1.0mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):V正~c(CH4)和V逆~c(CO)。则与曲线V正~c(CH4)相对应的是图中曲线 (填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为 (填字母)。
(3)用稀氨水喷雾捕集CO2时有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g) + CO2(g)。实验测得的有关数据如下表(t1<t2<t3):
氨基甲酸铵的分解反应是 (填“放热”或“吸热”)反应。在15℃,此反应的化学平衡常数K= 。
27.(14分)粉煤灰的综合利用既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中铝、铁元素的分离工艺流程如下:
(1)Al的原子结构示意图为 。“酸浸”时,Al2O3发生反应的离子方程式为 。
(2)有关金属离子以氢氧化物形式沉淀时离子浓度随pH变化如图1所示。沉铝时加入氨水后溶液pH的范围是 。
(3)沉铝后所得FeSO4用EDTA络合后可用于烟气中NO的吸收,其原理为[Fe(EDTA)]2+ + 2NO [Fe(EDTA)(NO)2]2+。EDTA络合吸收结合生物转化去除NO的装置如图2所示,生物反应器中发生反应的离子方程式为 。
(4)Al(OH)3经过一系列反应可获得粗铝(含少量Fe与Si杂质),利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图3所示)。
①该装置工作时,电极A作 极。阳极的电极反应式为 。
②熔融粗铝时,加入铜的作用是 。
28.(15分)叠氮化钠(NaN3)是一种应用广泛的无色无味、可溶于水的晶体,可用作医药原料,由叠氮化钠可制备四唑类化合物,再进一步合成抗生素头孢菌素药物。已知:
物质
CH3OH
CH3ONO(亚硝酸甲酯)
N2H4
NaN3
沸点/℃
64.7
-12
113.5
300
(1)制备NaN3,装置如下图所示。
①装置I中发生的反应为NaNO2 + HNO3 + CH3OH → NaNO3 + CH3ONO↑+ H2O。仪器M的名称是 ;仪器N的进水口是 (填“a”或“b”);仪器N的作用是 。
②30℃时,水合肼(N2H4·H2O)与亚硝酸甲酯(CH3ONO)、NaOH在装置II中反应。将反应后锥形瓶内的混合物进行蒸馏可回收CH3OH,母液降温结晶,过滤得NaN3粗品,重结晶得到NaN3产品。装置II中的多孔球泡的作用是 。写出生成NaN3的化学方程式: 。
③装置III中倒置漏斗的作用是 。
(2)测定NaN3产品纯度:称取NaN3产品(杂质只有NaOH)8.000g,用适量稀硫酸溶解后配成100.00mL溶液A;取25.00mL溶液A放入锥形瓶中,用0.2000mol·L-1的酸性KMnO4溶液滴定,消耗KMnO4溶液25.00mL。滴定时发生的反应为10NaN3 + 2KMnO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 8H2O + 15N2↑。
①到达滴定终点时的现象是 。
②NaN3产品的纯度是 。
(二)选考题(共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。)
35.[化学—物质结构与性质](15分)海底热液的研究是当今科研的热点,海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿、钙钛矿、锰结核等矿物。图1是海底“黑烟囱”喷发的热液的组成示意图。请回答下列问题:
(1)图1海底“黑烟囱”喷发的气体中,互为等电子体的是 。
(2)Cu的基态核外电子排布式为 。Mn2+的基态核外电子中未成对电子数为 。
(3)砷、镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是 。
(4)在AlCl3存在下,将C2H2通入AsCl3中可得到(ClCH=CH)2AsCl,AsCl3分子的空间构型为 。(ClCH=CH)2AsCl中碳原子的杂化轨道类型为 。1个(ClCH=CH)2AsCl分子中含σ键的数目为 。
(5)连接四个不同的原子或基团的碳原子称为手性碳原子。海底热液中存在一种人形有机分子,其结构如图2所示,该分子中有 个手性碳原子。
(6)GaAs是一种重要的半导体材料,其晶胞结构如图3所示,该材料晶体中n(Ga):n(As)
= 。已知晶体的晶胞参数为anm,则该材料晶体的密度为 g·cm-3(用含a、NA的代数式表示)。
36.[化学—有机化学基础](15分)福酚美克是一种影响机体免疫功能的药物,可通过以下方法合成:
已知:
(1)C的名称为 ,A的结构简式为 。
(2)福酚美克中所含官能团有 (填名称)。E→F的反应类型为 。
(3)已知G→H的转化属于取代反应,则该反应的另一产物的结构简式为 。
(4)写出F发生银镜反应的化学方程式: 。
(5)B的一种同分异构体Q满足下列条件,则Q的结构简式为 。
①Q的苯环上只有2个对位取代基,且Q的核磁共振氢谱图中有5组吸收峰
②Q不能发生银镜反应
③1molQ最多能与4molNaOH发生反应
(6)根据已有知识并结合题给信息,写出以乙烯和A为原料(无机试剂任用)制备的合成路线流程图:
。
全国100所名校最新高考模拟示范卷·理科综合卷(四)
化学试卷参考答案
一.选择题(本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。)
题号
7
8
9
10
11
12
13
答案
B
B
A
D
C
D
D
三.非选择题(包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须作答。第33题~第38题为选考题,考生根据要求作答。)
(一)必考题(11题,共129分)
26.(每空2分,共14分)
(1)
(2)①+247.3kJ·mol-1 ②乙 E
(3)吸热 4×10-6
27.(每空2分,共14分)
(1) Al2O3 + 6H+ = 2Al3+ + 3H2O
(2)5~7(5≤pH<7)
(3)C6H12O6 + 6[Fe(EDTA)(NO)2]2+ = 6[Fe(EDTA)]2+ + 6N2↑+ 6CO2↑+ 6H2O
(4)①阴 Al – 3e- = Al3+ ②增大阳极熔融物的密度
28.(15分)
(1)①三颈烧瓶(2分) a(1分) 冷凝回流甲醇(1分)
②增大CH3ONO与反应液的接触面积,加快反应速率(2分)
N2H4 + CH3ONO + NaOH = NaN3 + CH3OH + 2H2O(2分)
③防止倒吸(2分)
(2)①滴入最后1滴KMnO4溶液,溶液由无色变为浅红色,且半分钟内不褪色(2分)
②81.25%(3分)
(二)选考题(共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。)
35.[化学—物质结构与性质](15分)
(1)CO2与COS(2分)
(2)1s22s22p63s23p63d104s1{或[Ar]3d104s1}(1分) 5(1分)
(3)Ga<Se<As(或镓<硒<砷)(2分)
(4)三角锥形(1分) sp2(1分) 11(1分)
(5)5(2分)
(6)1:1(2分) (2分)
36.[化学—有机化学基础](15分)
(1)甲醇(1分) (1分)
(2)羧基、羟基、氨基(2分) 氧化反应(1分)
(3)(2分)
(4)(2分)
(5)(2分)
(6)(4分)