- 559.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
6-1 化学反应与能量的变化
一、选择题
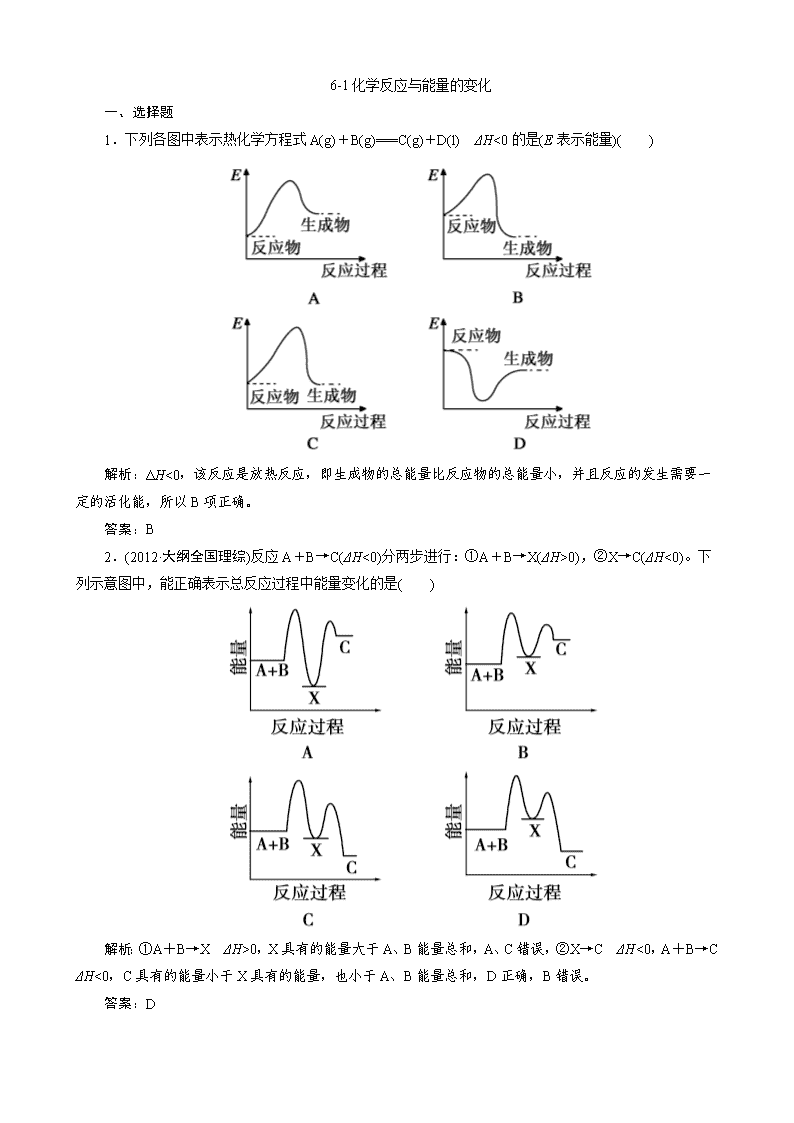
1.下列各图中表示热化学方程式 A(g)+B(g)===C(g)+D(l) ΔH<0 的是(E 表示能量)( )
解析:ΔH<0,该反应是放热反应,即生成物的总能量比反应物的总能量小,并且反应的发生需要一
定的活化能,所以 B 项正确。
答案:B
2.(2012·大纲全国理综)反应 A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下
列示意图中,能正确表示总反应过程中能量变化的是( )
解析:①A+B→X ΔH>0,X 具有的能量大于 A、B 能量总和,A、C 错误,②X→C ΔH<0,A+
B→C ΔH<0,C 具有的能量小于 X 具有的能量,也小于 A、B 能量总和,D 正确,B 错误。
答案:D
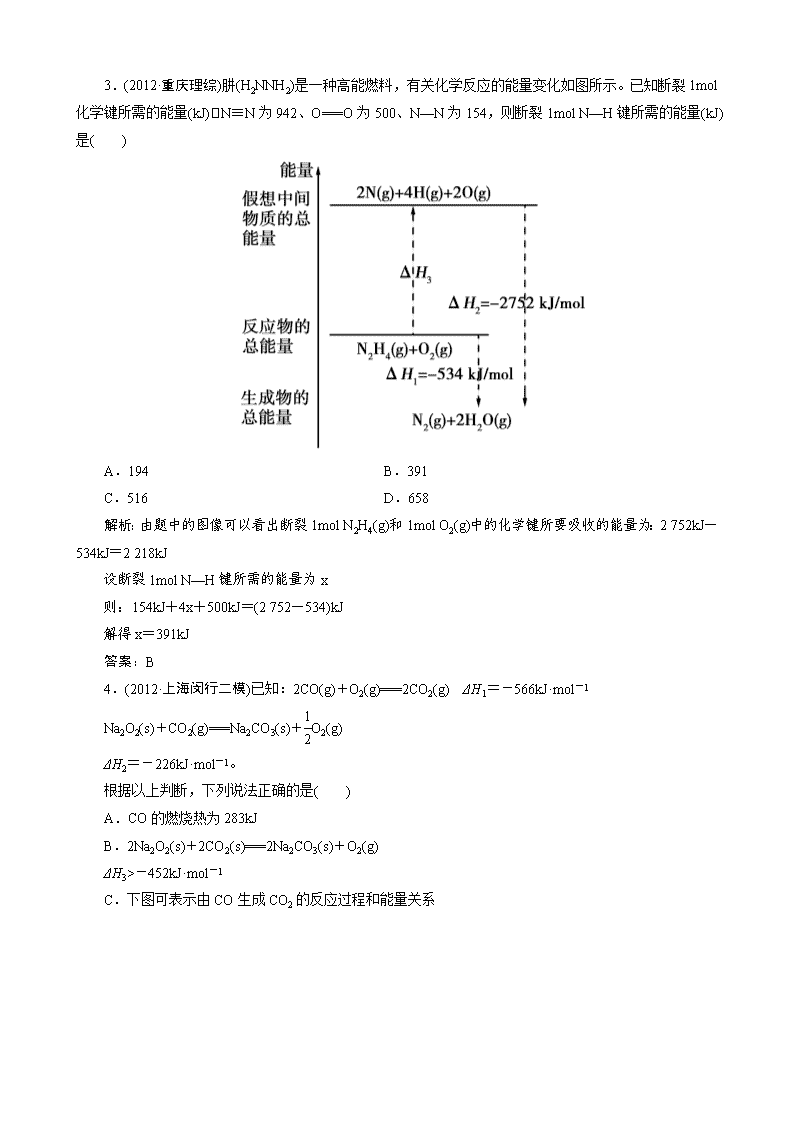
3.(2012·重庆理综)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂 1mol
化学键所需的能量(kJ) N≡N 为 942、O===O 为 500、N—N 为 154,则断裂 1mol N—H 键所需的能量(kJ)
是( )
A.194 B.391
C.516 D.658
解析:由题中的图像可以看出断裂 1mol N2H4(g)和 1mol O2(g)中的化学键所要吸收的能量为:2 752kJ
-534kJ=2 218kJ
设断裂 1mol N—H 键所需的能量为 x
则:154kJ+4x+500kJ=(2 752-534)kJ
解得 x=391kJ
答案:B
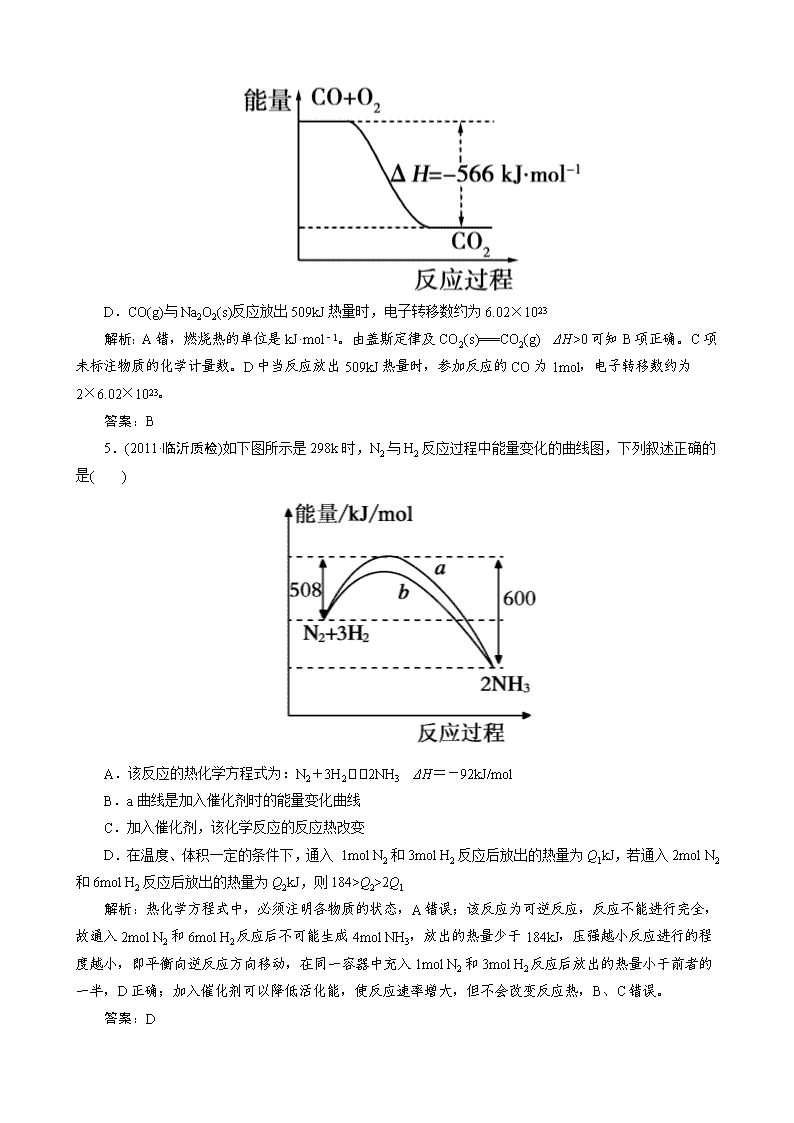
4.(2012·上海闵行二模)已知:2CO(g)+O2(g)===2CO2(g) ΔH1=-566kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+1
2O2(g)
ΔH2=-226kJ·mol-1。
根据以上判断,下列说法正确的是( )
A.CO 的燃烧热为 283kJ
B.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)
ΔH3>-452kJ·mol-1
C.下图可表示由 CO 生成 CO2 的反应过程和能量关系
D.CO(g)与 Na2O2(s)反应放出 509kJ 热量时,电子转移数约为 6.02×1023
解析:A 错,燃烧热的单位是 kJ·mol-1。由盖斯定律及 CO2(s)===CO2(g) ΔH>0 可知 B 项正确。C 项
未标注物质的化学计量数。D 中当反应放出 509kJ 热量时,参加反应的 CO 为 1mol,电子转移数约为
2×6.02×1023。
答案:B
5.(2011·临沂质检)如下图所示是 298k 时,N2 与 H2 反应过程中能量变化的曲线图,下列叙述正确的
是( )
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92kJ/mol
B.a 曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入 1mol N2 和 3mol H2 反应后放出的热量为 Q1kJ,若通入 2mol N2
和 6mol H2 反应后放出的热量为 Q2kJ,则 184>Q2>2Q1
解析:热化学方程式中,必须注明各物质的状态,A 错误;该反应为可逆反应,反应不能进行完全,
故通入 2mol N2 和 6mol H2 反应后不可能生成 4mol NH3,放出的热量少于 184kJ,压强越小反应进行的程
度越小,即平衡向逆反应方向移动,在同一容器中充入 1mol N2 和 3mol H2 反应后放出的热量小于前者的
一半,D 正确;加入催化剂可以降低活化能,使反应速率增大,但不会改变反应热,B、C 错误。
答案:D
6.已知反应:①101kPa 时,2C(s)+O2(g)===2CO(g)
ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3kJ·mol-1
③红磷的化学式为 P,白磷的化学式为 P4,已知 P4(s)+5O2(g)===P4O10(s) ΔH=-3093.2kJ·mol-1,4P(s)
+5O2(g)===P4O10(s) ΔH=-2954.0kJ·mol-1
下列结论正确的是( )
A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低
B.碳的燃烧热大于 110.5kJ·mol-1
C.稀硫酸与稀 NaOH 溶液反应的中和热为-57.3kJ·mol-1
D.稀醋酸与稀 NaOH 溶液反应生成 1mol 水,放出 57.3kJ 热量
解析:由题给白磷和红磷燃烧的热化学方程式可得:
4P(s)===P4(s) ΔH=+139.2kJ·mol-1,说明红磷转化为白磷是吸热反应,因此等质量的红磷能量比白
磷低,A 项错误;1mol C 不完全燃烧生成 CO 放出热量221 kJ
2
=110.5kJ,1mol C 完全燃烧生成 CO2 放出热
量要大于 110.5kJ,即 C 的燃烧热大于 110.5kJ·mol-1,B 项正确;稀硫酸与稀 NaOH 溶液反应的中和热为
57.3kJ·mol-1 或中和热为ΔH=-57.3kJ·mol-1,C 项错误;稀醋酸是弱酸,与 NaOH 溶液中和生成 1mol 水
时放出的热量小于 57.3kJ,D 项错误。
答案:B
7.已知 H2(g)+Br2(l)===2HBr(g) ΔH=-72kJ/mol,蒸发 1mol Br2(l)需要吸收的能量为 30kJ,其他的
相关数据如下表:
H2(g) Br2(g) HBr(g)
1mol 分子中的化学键断裂时需要
吸收的能量/kJ
436 a 369
则表中 a 为( )
A.404 B.260
C.230 D.200
解析:由 H2(g)+Br2(l)===2HBr(g) ΔH=-72kJ/mol①
Br2(l)===Br2(g) ΔH=+30kJ/mol②
①-②得 H2(g)+Br2(g)===2HBr(g) ΔH=-102kJ/mol
由 436kJ/mol+a-369kJ/mol×2=-102kJ/mol 得
a=200kJ/mol。
答案:D
8.已知键能是指常温常压下拆开 1mol 理想气体分子 AB 需要吸收的能量。下表是某些共价键的键能:
共价键
键能
/kJ·mol-1
共价键
键能
/kJ·mol-1
共价键
键能
/kJ·mol-1
H—H 436 H—Br 366 Cl—Cl 243
H—O 463 H—I 298 Br—Br 193
H—Cl 432 O===O 496 I—I 151
根据上述表格中的数据,下列表述正确的是( )
A.H2O 中含有两个 O—H 共价键,故用氢气与氧气合成 1mol H2O 放出的能量为 926kJ
B.用单质合成 1mol H—Cl 所放出的能量小于合成 1mol H—Br 所放出的能量
C.当用表中卤素单质与氢气合成卤化氢时,所有的反应都是放热反应
D.合成溴化氢的热化学方程式为:H2(g)+Br2(g)===2HBr(g) ΔH=-103kJ·mol-1
解析:合成 1mol H2O 需要 1mol H2 和 0.5mol O2,故该过程放出的能量为 2×463kJ·mol-1×1mol-
436kJ·mol-1×1mol-496kJ·mol-1×0.5mol=+242kJ,A 错;通过计算可得合成 1mol H—Cl 所放出的能量
大于合成 1mol H—Br 所放出的能量,分别为 92.5kJ、51.5kJ,B 错。
答案:CD
9.(2012·山东临沂二模)肼(N2H4)是火箭发动机的燃料,它与 N2O4 反应时,N2O4 为氧化剂,生成氮气
和水蒸气。已知:N2(g)+2O2(g)===N2O4(g) ΔH1=+8.7kJ·mol-1;N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2
=-534.0kJ·mol-1,下列表示肼跟 N2O4 反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 059.3kJ·mol-1
C.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 076.7kJ·mol-1
D.N2H4(g)+1
2N2O4(g)===3
2N2(g)+2H2O(g)
ΔH=-1 076.7kJ·mol-1
解析:N2(g)+2O2(g)===N2O4(g) ΔH1=+8.7kJ·mol-1①,
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534.0kJ·mol-1②,
将热化学方程式②×2-①就可以得到肼与 N2O4 反应的热化学方程式,则ΔH=-534.0kJ·mol-1×2-
8.7kJ·mol-1=-1 076.7kJ·mol-1,选项 C 正确。
答案:C
10.(2012·河北石家庄高三一检)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH=-24.8kJ·mol-1
Fe2O3(s)+1
3CO(g)===2
3Fe3O4(s)+1
3CO2(g)
ΔH=-15.73kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH=+640.4kJ·mol-1
则 14g CO 气体还原足量 FeO 固体得到 Fe 固体和 CO2 气体时对应的ΔH 约为( )
A.-218kJ·mol-1 B.-109 kJ·mol-1
C.+218kJ·mol-1 D.+109kJ·mol-1
解析:该问题可以转化为 1
2CO(g)+1
2FeO(s)===1
2Fe(s)+1
2CO2(g) ΔH=?所以应用盖斯定律,若把已知
给出的 3 个热化学方程式按照顺序编号为①②③,那么[(①-②)×3
2
-③]×1
6
即可。
答案:B
11.(2012·广东天河二模)25℃、101kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5kJ·mol
-1、ΔH=-285.8kJ·mol-1、ΔH=-890.3kJ·mol-1、ΔH=-2 800kJ·mol-1,则下列热化学方程式正确的是
( )
A.C(s)+1
2O2(g)===CO(g)
ΔH=-393.5kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3kJ·mol-1
D.1
2C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)
ΔH=-1 400kJ·mol-1
解析:注意反应物,生成物的状态与反应热的关系。
答案:B
12.(2011·重庆高考)SF6 是一种优良的绝缘气体,分子结构中只存在 S-F 键。已知:1mol S(s)转化为
气态硫原子吸收能量 280kJ,断裂 1molF-F、S-F 键需吸收的能量分别为 160kJ、330kJ,则 S(s)+
3F2(g)===SF6(g)的反应热ΔH 为( )
A.-1 780kJ/mol B.-1 220kJ/mol
C.-450kJ/mol D.+430kJ/mol
解析:ΔH=280kJ·mol-1+160kJ·mol-1×3-330kJ·mol-1×6=-1 220kJ·mol-1。
答案:B
13.已知:(1)H2(g)+1
2O2(g)===H2O(g) ΔH1=akJ/mol
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=bkJ/mol
(3)H2(g)+1
2O2(g)===H2O(l) ΔH3=ckJ/mol
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=dkJ/mol
下列关系式中正确的是( )
A.ad>0
C.2a=b<0 D.2c=d>0
解析:H2 的燃烧是放热反应,B、D 错。考虑到水的状态及ΔH<0,故 a>c,A 错。ΔH 与方程式中各
物质的化学计量数成正比,故 2a=b<0。
答案:C
14.(2011·福建龙岩一模)C(石墨)在高温、高压及催化剂存在的条件下能转化为 C(金刚石),该反应为
吸热反应,由此可知( )
A.石墨比金刚石稳定
B.石墨总能量比等质量的金刚石高
C.该变化属于物理变化
D.该反应的焓变ΔH<0
解析:判断本题各个说法正误的依据是:物质的能量状态越高,越不稳定。据题意石墨转化为金刚石
为吸热反应,则表明石墨能量状态低,更稳定,A 正确;B 错;石墨、金刚石是两种不同的物质,其转化
属于化学变化,C 错;吸热反应的焓变表示应为ΔH>0,D 错。
答案:A
15.(2011·湖南三十二校联考)下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为 285.8kJ/mol,则水电解的热化学方程式为:
2H2O(l)===2H2(g)+O2(g) ΔH=+285.8kJ/mol
B.1mol 甲烷完全燃烧生成 CO2 和 H2O(l) 时放出 890kJ 热量,它的热化学方程式为:1/2CH4(g)+
O2(g)===1/2CO2(g)+H2O(l) ΔH=-445kJ/mol
C.已知 2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则 C 的燃烧热为 110.5kJ/mol
D.HF 与 NaOH 溶液反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol
解析:燃烧热的概念是:在 101kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,而
这里水电解的热化学方程式中生成 2mol H2,则ΔH=+571.6kJ/mol,A 选项错;热化学方程式中热量值要
与方程式中反应物的物质的量成比例,这里 1mol 甲烷完全燃烧放出 890kJ 热量,1
2mol CH4 完全燃烧放出
445kJ 的热量,B 选项正确;C 选项中碳燃烧生成 CO,不是稳定的氧化物,应该为 CO2,C 选项错;由于
HF 是弱酸,不完全电离,在与 NaOH 反应时,发生电离而吸热,则最终放出的热量小于 57.3kJ,D 选项
错。
答案:B
二、非选择题
16.(2012·山东济南一模)硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为_________________________
_______________________________________________。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为
氮气和水,反应机理为:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160kJ·mol-1
则甲烷直接将 NO2 还原为 N2 的热化学方程式为
___________________________________________________________________________________________
_____________________________________________________。
解析:根据盖斯定律将(①+②)×1
2
得 CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH=-867kJ·mol
-1。
答案:(1)4NH3+5O2 =====
催化剂
△
4NO+6H2O
(2)CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH=-867kJ·mol-1
17.水煤气(主要成分 CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。已知:
①C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.3kJ/mol
②C(s)+1
2O2(g)===CO(g)
ΔH=-110.5kJ/mol
③CO(g)+1
2O2(g)===CO2(g)
ΔH=-283.0kJ/mol
④H2(g)+1
2O2(g)===H2O(g)
ΔH=-241.8kJ/mol
⑤H2(g)+1
2O2(g)===H2O(l)
ΔH=-285.5kJ/mol
(1)将 2.4g 炭转化为水煤气,再完全燃烧,整个过程放出的热量为________kJ。
(2)由 CO、H2 在一定条件下获得汽油的替代品——甲醇,甲醇的燃烧热为 726.5kJ/mol,试写出由 CO、
H2 生成甲醇的热化学方程式________________________________________________________
________________。
解析:(1)因始态为 C(s),终态为 CO2(g),由盖斯定律可知焓变与 0.2mol C(s)转化为 CO2(g)的焓变相
同。由②+③可得 C(s)+O2(g)===CO2(g) ΔH=-393.5kJ/mol,故 2.4g 炭在此过程放出热量为 78.7kJ。(2)
根据甲醇的燃烧热可得热化学方程式⑥CH3OH(l)+3
2O2(g)===CO2(g)+2H2O(l) ΔH=-726.5kJ/mol,③+
⑤×2-⑥得 CO(g)+2H2(g)===CH3OH(l) ΔH=-128.1kJ/mol
答案:(1)78.7
(2)CO(g)+2H2(g)===CH3OH(l) ΔH=-128.1kJ/mol
18.化学键的键能是指气态原子间形成 1mol 化学键时释放的能量。如 H(g)+I(g)===HI(g) ΔH=-
297kJ/mol,即 H—I 键的键能为 297kJ/mol,也可以理解为破坏 1mol H—I 键需要吸收 297kJ 的能量。一个
化学反应一般有旧化学键的断裂和新化学键的形成。
如下表是一些键能数据(kJ/mol):
键能(kJ/mol)
键能
(kJ/mol)
键能(kJ/mol) 键能(kJ/mol)
H—H 436 Cl—Cl 243 H—Cl 431 H—O 464
S===S 255 H—S 339 C—F 427 C—O 347
C—Cl 330 C—I 218 H—F 565
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)________(填
“能”或“不能”);②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”);能否由
数据找出一些规律,请写出一条:__________________
________________________________________________________________________;试预测 C-Br 键的键
能范围:________________