- 997.84 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第21讲 晶体的结构
(建议2课时完成)
[考试目标]
1.了解物质的聚集状态。(选考内容)
2.认识晶体的概念和特性。(选考内容)
3.认识晶体结构的堆积模型,了解晶胞的含义。(选考内容)
4.通过代表物认识金属晶体、离子晶体、分子晶体和原子晶体的结构特点。(选考内容)
5.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。(选考内容)
6.能进行有关晶胞或晶体的有关简单计算。(选考内容)
[要点精析]
一、认识晶体
1.晶体的定义:微观粒子在空间按一定规律做周期性重复排列构成的固体物质
2.晶体的特性:
(1)有规则的几何外形(自范性:在适宜的条件下,晶体能够自发的呈现封闭的、规则的多面体外形。)
(2)有确定的熔点
(3)各向异性:在不同的方向上表现不同的性质
(4)具有特定的对称性
3.晶体结构的堆积模型
(1)堆积原则:①在金属晶体、离子晶体和分子晶体的结构中,由于金属键、离子键和分子间作用力均没有方向性,因此,都趋向于使原子或分子吸引尽可能多的其他原子或分子分布于周围,并以密堆积的方式降低体系的能量,使晶体变得比较稳定----即排列服从紧密堆积原理。②对原子晶体,受共价键的方向性和饱和性的影响,其空间排列与方向性一致。例如:金刚石:SP3杂化,正四面体;石墨:SP2杂化,正六边形。
(2)等径圆球的密堆积
①A3型密堆积。即…ABAB…
②A1型密堆积。即…ABCABC…
(3)非等径圆球的密堆积
离子晶体:将较大的离子按等径圆球进行密堆积,而较小的离子则有序的填入其空隙中。
分子晶体:采取紧密堆积方式,但分子的排列与分子的形状有关。
4.晶体结构的基本单元—晶胞
由于晶体中的微粒排列呈现周期性,因此,研究晶体结构时只需找出最小的重复单元加以分析,就知道整个晶体的结构了。
晶胞:晶体中最小的结构重复单元。
对晶胞的理解:(1)平移一个胞长后可以重合。
(2)二维晶胞为平行四边形;三维晶胞为平行六面体。
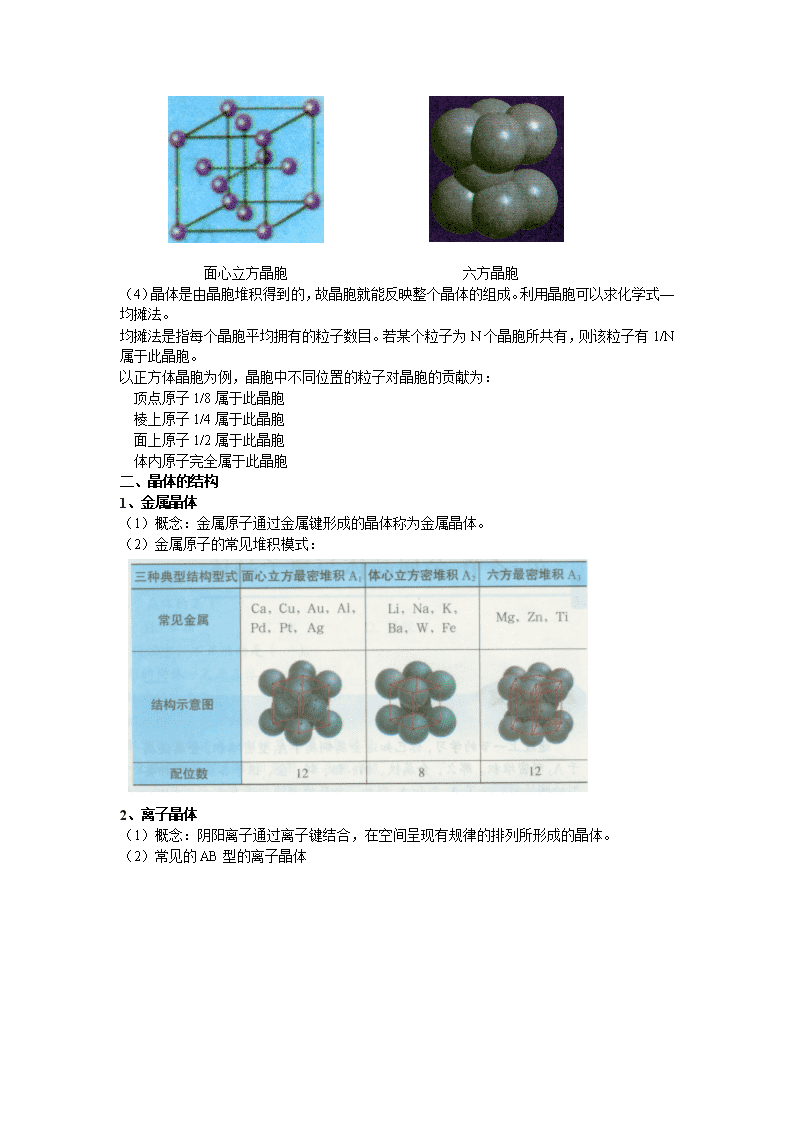
(3)实例:六方晶胞和面心立方晶胞
面心立方晶胞 六方晶胞
(4)晶体是由晶胞堆积得到的,故晶胞就能反映整个晶体的组成。利用晶胞可以求化学式—均摊法。
均摊法是指每个晶胞平均拥有的粒子数目。若某个粒子为N个晶胞所共有,则该粒子有1/N属于此晶胞。
以正方体晶胞为例,晶胞中不同位置的粒子对晶胞的贡献为:
顶点原子1/8属于此晶胞
棱上原子1/4属于此晶胞
面上原子1/2属于此晶胞
体内原子完全属于此晶胞
二、晶体的结构
1、金属晶体
(1)概念:金属原子通过金属键形成的晶体称为金属晶体。
(2)金属原子的常见堆积模式:
2、离子晶体
(1)概念:阴阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
(2)常见的AB型的离子晶体
①氯化钠
晶胞:Cl-以面心立方堆积,Na+占据Cl-围成的所有正八面体空隙(1+12×1/4)
配位数:6、6。即每个钠离子周围距离最近且相等的氯离子有六个,每个氯离子周围距离最近且相等的钠离子有六个,每个钠离子周围距离最近且相等的钠离子有12个,每个氯离子周围距离最近且相等的氯离子有12个。
晶胞中Na+和Cl-的数目分别为:4、4
②氯化铯
晶胞:Cl-以简单立方堆积,Cs+占据Cl-围成的简单立方的体心
配位数:8、8。即每个铯离子周围距离最近且相等的氯离子有8个,每个氯离子周围距离最近且相等的铯离子有8个,每个铯离子周围距离最近且相等的铯离子有6个,每个氯离子周围距离最近且相等的氯离子有6个。
晶胞中Cs+和Cl-的数目分别为:1、1
③ZnS
晶胞:S2-以面心立方堆积,Zn2+占据S2-围成的八个正四面体空隙中的四个互不相邻的正四面体空隙。
配位数:4、4。即每个硫离子周围距离最近且相等的锌离子有4个,每个锌离子周围距离最近且相等的硫离子有4个。
晶胞中Na+和Cl-的数目分别为:4、4
(3)晶格能--用来定量衡量离子键的强弱
①概念:指1摩尔离子化合物中阴阳离子,由相互远离的气态结合成离子晶体时所放出的能量。放出的能量越多,晶格能越大,表示离子键越强,离子晶体越稳定。
②晶格能∝q+q-/r2 (除此之外还与晶体的结构形式有关)
3、原子晶体
(1)概念:相邻原子间以共价键相结合而形成的具有空间立体网状结构的晶体称为原子晶体。
(2)几种常见的原子晶体
①金刚石
结构:空间网状结构,碳原子以SP3杂化与它紧邻的四个碳原子以共价键结合。键角109.5。。晶体内最小环为六元环。12克金刚石含2摩尔共价键。
晶胞:在面心立方中,顶点与三个面心原子构成正四面体,共8
个,每间隔一个四面体中有一个原子。
配位数:4
②晶体硅:与金刚石结构相同
③金刚砂:将金刚石中一半的碳换为硅,碳原子和硅原子的位置是交替的。
④水晶:在晶体硅结构中的每个Si-Si键中插入一个氧原子,便可得到以硅氧四面体为骨架的二氧化硅的结构。最小环为12元环。
4、混合晶体-石墨
结构:平面网状结构,碳原子以SP2杂化与它紧邻的三个碳原子以共价键结合,键角120。。平面内存在πnn,大π键具有金属键的特性。平面间以分子间作用力结合。晶体内最小环为六元环。12克金刚石含1.5摩尔共价键。
5、分子晶体
(1)概念:分子间通过分子间作用力结合形成的晶体称为分子晶体。
(2)几种常见的分子晶体
①氯、溴、碘单质形成的晶体:长方体型。
②二氧化碳晶体:立方体型。平均每个晶胞中有4个二氧化碳分子;每个二氧化碳周围距离最近且相等的二氧化碳有12个。
6、晶胞参数的计算
例题:已知氯化钠的密度为dg/ml,求氯化钠晶胞的边长?
解析:根据关系式dVL=ZM,其中d是密度,V是一个晶胞的体积,L是阿伏加德罗常数,Z是一个晶胞里含有氯化钠微粒的个数,M是氯化钠的式量。 a=(4M/dL)1/3(cm)
[过关训练]
一、单项选择题
1、在石墨晶体中,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为( )
A. 6 B. 4 C. 3 D. 2
2.(选考内容)1987年2月,朱经武教授等发现钇钡铜氧化物在90K温度下即具有超导性。若该化合物的结构单元如右图所示,该化合物的化学式可能为( )
A YBa2CuO7-x B YBa2Cu2O7-x
C YBa2Cu3O7-x D YBa2Cu4O7-x
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成第3、4题:
3.(选考内容)下列关于天然气水合物中两种分子极性的描述正确的是( )
A 两种都是极性分子 B 两种都是非极性分子
C CH4是极性分子,H2O是非极性分子 D H2O是极性分子,CH4是非极性分子
4.(选考内容)若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )
A CH4·14H2O B CH4·8H2O C CH4·(23/3)H2O D CH4·6H2O
5、(选考内容)近年来科学家发现有100个碳原子构成一个具有完美对称的C100原子团,其中每个碳原子仍可形成4个化学键。最内层是由20个碳原子构成的正十二面体(即每个碳与其他3个碳相连)。外层的60个碳原子形成12个独立的正五边形(即每个碳与其他2个碳相连)。处于中间层次的碳原子连接内外层碳原子。当它与氢或氟形成分子时,其分子式为( )
A.C100 H20和C100 F20 B.C100 H60和C100 F60
C.C100 H12和C100 F12 D.C100 H40和C100 F40
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
○
●
●
●
●
●
●
○
○
●
○
B
Mg
6.(选考内容)硼镁化合物刷新了金属化合物超导温度的最高记录。该化合物晶体结构中的重复结构单元如图所示。十二个镁原子间形成正六棱柱,两个镁原子分别在棱柱上底、下底的中心;六个硼原子位于棱柱内。则该化合物的化学式可表示为
A.Mg14B6 B.MgB2
C.Mg5B12 D.Mg3B2
7.(选考内容)碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn—的化学式为( )
A.I2O94— B.I2O106— C.I2O118— D.I2O1210—
8.(选考内容)纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某硼镁化合物的结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A 22% B 70% C 66.7% D 33.3%
二、双项选择题
9、(选考内容)已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,但化学键没有金刚石牢固
B.该晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子
C.该晶体中碳原子与氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
10、(选考内容)下列有关晶体的叙述中,不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子。
B.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个。
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻10个CO2分子
11、(选考内容)北京大学与中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A.K3C60中既有离子键又有非极性键
B.1摩尔K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该晶体的化学式可写为KC20
12、(选考内容)经X射线研究证明PCl5在固态时,由空间构型分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是( )
A.PCl5固体是离子晶体
B.PCl5晶体由[PCl3]2+和[PCl7]2-构成,且离子数目之比为1:1
C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数目之比为1:1
D.PCl5晶体具有良好的导电性
13、(选考内容)以知氯化钠的摩尔质量为M g/mol,某一定条件下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为b g/mL。依据中学教材氯化钠的晶体结构图判断下列叙述正确的是( )
A. 每个钠离子周围最近且等距离的氯离子所围成的空间构型为正六面体
B. 每个钠离子周围最近且等距离的氯离子所围成的空间构型为正八面体
C. 阿伏加德罗常数NA可表示为M/2a3b
D. 阿伏加德罗常数NA可表示为4M/a3b
14、水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
15、(选考内容)据报道,有科学家用激光将置于铁室中石墨靶上的碳原子炸松,与此同时再用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜。据称,这种化合物可能比金刚石更坚硬。不能用来解释其原因的是( )
A.碳、氮原子构成网状结构的原子晶体
B.碳氮键比金刚石中的碳碳键更短,键能更大
C.氮原子最外层电子数比碳原子最外层电子数多
D.碳、氮的单质化学性质均不活泼
16、(选考内容)最近科学家成功的制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述不正确的是( )
A.该物质的化学式为CO2
B.晶体的熔沸点高、硬度大
C.晶体中碳原子数与C-O化学键数之比为1:4
D.该物质的性质与二氧化碳相似
17.(选考内容)下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D. Na2O2晶体中阴离子与阳离子数目之比为1:1
18、(选考内容)下列关于晶体的说法正确的是( )
A 分子晶体中都存在共价键
B 右图所示CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C SiO2晶体中每个硅原子与2个氧原子以共价键相结合
D 金属晶体的熔点不一定比分子晶体的熔点高
三、填空题
19、根据CsCl晶体结构可知,一个Cs+同时吸引着_____个Cl-,一个Cl-同时吸引着_____个 Cs+ ;与1个Cs+距离相等且最近的Cs+有_______个。
20、(选考内容)构成分子晶体的微粒是___________,它们彼此以__________相结合;构成原子晶体的微粒是__________,它们彼此以_________相结合;构成离子晶体的微粒是__________,它们彼此以_________相结合。
21、(选考内容)在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有_____个碳原子,每个碳原子上的任意两个C-C键的夹角都是_______(填角度)。
22、(选考内容)许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视做由若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为___________
23、已知白磷与氧气反应得到的P2O3和P2O5分子实际上是P4O6和P4O10分子。请你根据白磷的分子结构画出P4O6和P4O10的分子构型。
P
P
P
P
24、BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在GBO中,锗处于其最高价态 ②在GBO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构 ③GBO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在GBO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)GBO晶体的化学式是 。
(3)GBO晶体中所含铋氧化物的化学式是 。
25、(选考内容)A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融时能导电。试回答下列问题:
(1)A、B的元素符号分别是______,_______。
(2)用电子式表示A、B元素形成化合物的过程:_______________________________
(3)A、B所形成的化合物的晶体结构跟NaCl的晶体结构相似,则每个阳离子周围吸引了_________个阴离子。晶体中阴、阳离子数之比为____________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是________________________。
26、(选考内容)下图表示一些晶体中的某些结构,他们分别是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是 (填编号字母,下同),金刚石中每个碳原子与 个碳原子最接近且距离相等。金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个;
(3)其中表示氯化钠的是 ,每个钠离子周围与它最接近且距离相等的钠离子有
个;
(4)代表氯化铯的是 ,它属于 晶体,每个铯离子与 个氯离子紧邻;
(5)代表干冰的是 ,它属于 晶体,每个二氧化碳分子与 个二氧化碳分子紧邻;
(6)上述五种物质熔点由高到低的排列顺序为
27、(选考内容)右下图是石英晶体平面示意图,它实际上是立体的网状结构,其中硅、氧原子数之比为 .原硅酸根离子SiO44-的结构可表示为左图.二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为 。
28、(选考内容)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定律
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是: _______ .
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)_________,并简述其理由:___________________________________.
(3)通过计算,确定C60分子所含单键数:C60分子所含单键数为_______________.
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目. C70分子中所含五边形数为________,六边形数为_______.
四、计算题
29、(选考内容)晶体具有规则的几何外形。已知氯化钠晶体结构如下图所示。FexO晶体结构为氯化钠型,由于晶体缺陷,x值小于1。测知FexO晶体密度为d=5.71g/ml,晶胞边长为4.28×10-10m。
(1)FexO的摩尔质量为多少?(要求写计算过程)
(2)FexO中x的值为 (精确至0.01)(直接填写结果)
(3)晶体中的Fen+分别为Fe2+和Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数为 (用小数表示,精确至0.001)(直接填写结果)
(4)此晶体的化学式为 (直接填写结果)
(5)与某个Fe2+(或Fe3+)距离最近且相等的O2-围成的空间几何形状是
(6)在晶体中,铁元素的离子间最短距离为多少?(要求写计算过程)
30、(选考内容)右图所示为Li2S的晶胞,晶胞的边长为5.88×10-10m。
(1)在一个Li2S晶胞中存在________个Li+ 和
_____个S2-。
(2)通过计算说明Li2S晶体的密度为多大。
31、(选考内容)(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。 NiO(氧化镍〕晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算
NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下所述的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。若某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
参考答案
一、二选择题答案
题号
1
2
3
4
5
6
7
8
9
答案
D
C
D
B
B
B
A
B
AD
题号
10
11
12
13
14
15
16
17
18
答案
BD
AC
AC
BC
C
CD
D
A
BD
三、
19、8,8,6
20、分子,分子间作用力,原子,共价键,阴、阳离子,离子键
21、6,109.5。
22、CaTiO3
23、在白磷分子的每个P-P键之间插入一个氧原子即为P4O6的结构;在P4O6分子的每个P原子上再通过配位键连接一个氧原子即为P4O10的结构。
24、(1)Ge,Bi;(2)Bi4Ge3O12[或2Bi2O3·3GeO2、Bi4(GeO4)3];(3)Bi2O3
25、(1)Mg,O;(2)略;(3)6,1:1;(4)高,微粒间的距离相差不大,但Mg2+、O2-所带电荷多,形成离子键较强,故熔点较高。
26、(1)D 4 原子 (2)E 2 (3)A 12 (4)C 离子 8
(5)B 分子 12 (6)石墨>金刚石>氯化钠>氯化铯>干冰
27、1:2
28、(1) 金刚石,金刚石属原子晶体,而固体C60不是,故金刚石熔点较高.
(2) 可能,因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
(3)依题意,C60分子形成的化学键数为:(3×60)×1/2=90
也可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90
C60分子中单键为:90-30=60
(4)设C70分子中五边形数为x,六边形数为y.依题意可得方程组:
解得:五边形数x=12,六边形数y=25
四、
29、 (1)67.4g/mol (2)0.92 (3)0.826 (4)Fe2+0.76Fe3+0.16O (5)正八面体(6)3.02×10-10m
30、(1)6,3;(2)1.13g/cm3
31、(1)62/a3
(2)设1mol Ni0.97O中含Ni3+x mol, Ni2+(0.97-x)mol
根据电中性:3x mol + 2(0.97-x)mol=2×1mol
x=0.06
Ni2+为(0.97-x)mol=0.91
离子数之比 Ni3+ : Ni2+=0.06 : 0.91=6:91
(深圳中学 罗吉祥)