- 62.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《走进化学世界》复习课教学案 教师版
化学是研究物质的 以及其 的科学。
学习化学的一个重要途径是 , 是科学探究的重要手段。
1.原子论和分子学说。 和 等科学家研究得出了一个重要结论:物质是由 和 构成的;分子的 和 的重新组合是化学变化的基础,即在化学变化中 会破裂,而 不会破裂,但可重新组合成新分子,即原子是参加化学变化的最小粒子。
2.组成物质的基本成分—元素。门捷列夫发现了 和 ,使化学学习和研究变得有规律可循。
3.绿色化学的主要特点。
(1)充分利用资源和能源,采用无毒、无害的原料。
(2) 在无毒、无害的条件下进行化学反应,以减少废物向环境排放。
(3) 提高原子的利用率,力图使所有作为原料的原子都被产品所接纳,实现“零排放”。
(4) 生产出有利于环境保护、社区安全和人体健康的环境良好产品。
4.了解几种高科技的化学产品 , 如具有超塑延展性的 ; 隔水透气的高分子薄膜;小猫安详地坐在高温火焰加热的平板上,也是高分子化学材料,其特点是具有绝热的性质;超强拉力的尼龙绳等。
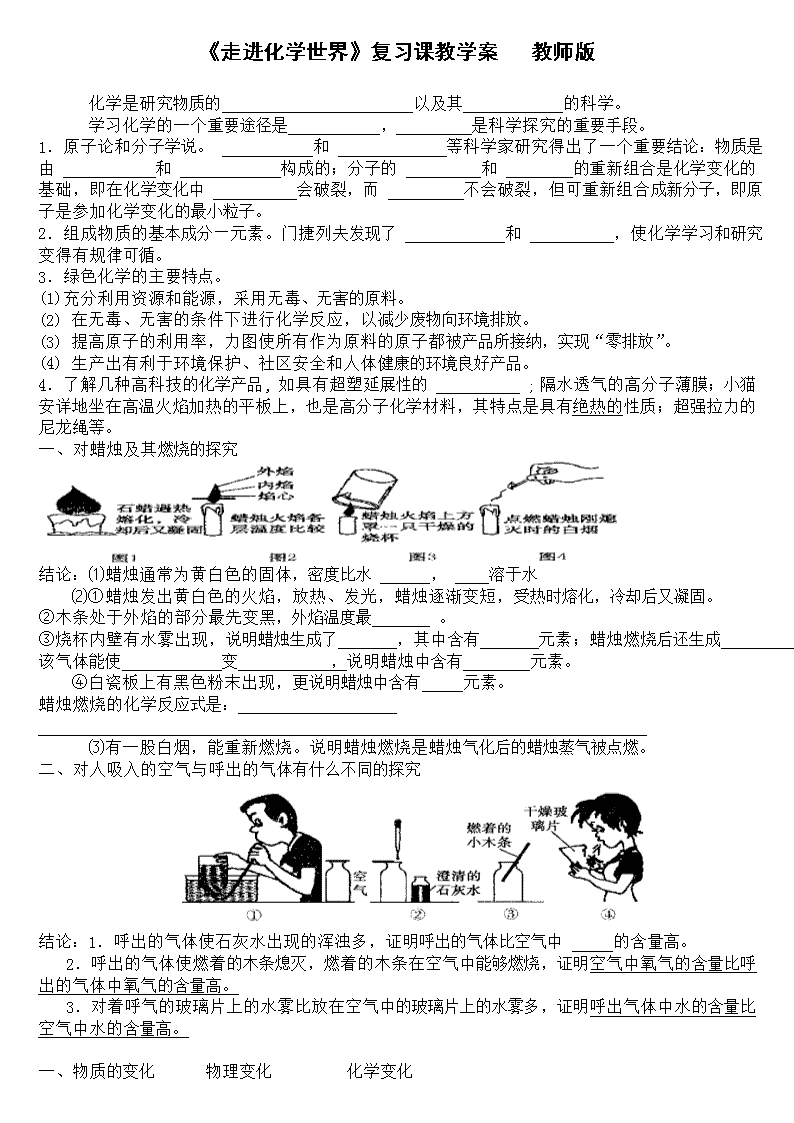
一、对蜡烛及其燃烧的探究
结论:⑴蜡烛通常为黄白色的固体,密度比水 , 溶于水
⑵①蜡烛发出黄白色的火焰,放热、发光,蜡烛逐渐变短,受热时熔化,冷却后又凝固。
②木条处于外焰的部分最先变黑,外焰温度最 。
③烧杯内壁有水雾出现,说明蜡烛生成了 ,其中含有 元素;蜡烛燃烧后还生成 ,该气体能使 变 ,说明蜡烛中含有 元素。
④白瓷板上有黑色粉末出现,更说明蜡烛中含有 元素。
蜡烛燃烧的化学反应式是:
⑶有一股白烟,能重新燃烧。说明蜡烛燃烧是蜡烛气化后的蜡烛蒸气被点燃。
二、对人吸入的空气与呼出的气体有什么不同的探究
结论:1.呼出的气体使石灰水出现的浑浊多,证明呼出的气体比空气中 的含量高。
2.呼出的气体使燃着的木条熄灭,燃着的木条在空气中能够燃烧,证明空气中氧气的含量比呼出的气体中氧气的含量高。
3.对着呼气的玻璃片上的水雾比放在空气中的玻璃片上的水雾多,证明呼出气体中水的含量比空气中水的含量高。
一、物质的变化 物理变化 化学变化
1.物理变化:没有生成其它物质的变化。
特征:没有其他物质生成,仅是形态的变化。
2.化学变化:变化时都生成了其它物质的变化(化学反应)。
特征:①有其他物质生成,常表现为颜色变化、放出气体、 生成沉淀
②常伴随能量变化,常表现为吸热、放热、发光等
3.两种变化的本质区别:变化中是否有其它物质生成。
4.联系:在化学变化的过程中,同时发生物理变化。
注意:判断物质变化不能仅仅依据是否有明显的现象,而应该看是否生成了其他物质,或者判断原物质的构成微粒有没有发生变化。有些化学变化是没有现象的,如一些中和反应,物理变化也可伴随有明显的现象如氧气液化时变成淡蓝色、电灯通电时发光也放热
二、物质的性质 物理性质 化学性质
1.物理性质:不需要发生化学变化就表现出来的性质。如:颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性等。
2.化学性质:通过化学变化表现出来的性质。如:可燃性、氧化性、还原性、稳定性、酸性、碱性等
注意:一般描述物质性质的语言中有“可、易、能、会”等表示具有能力的字眼,如镁带可以燃烧,糖能溶解与水。
练习:下列描述哪些是物理变化?哪些是化学变化?哪些是物理性质?哪些是化学性质?
A、铜绿受热时会分解; B、纯净的水是无色无味的液体;
C、镁带在空气中燃烧后变成了氧化镁; D、氧气不易溶于水且比空气密度大;
E、木棒受力折断; F、铁生锈; G、煤着火燃烧,残余一堆灰烬。
三、做好实验的要求
⑴课前要做好预习准备,明确实验要求。
⑵实验时要仔细观察,实事求是地做好记录,认真分析现象并做好实验报告。
⑶实验后的废物按要求处理,仪器要及时清洗,保持实验室整洁。
走进实验室:
一、常见仪器的使用:
蒸发皿、石棉网、坩埚钳、锥形瓶、长颈漏斗、药匙、胶头滴管、漏斗、干燥管、铁架台、试管、酒精灯、集气瓶、水槽、烧杯、量筒。
二、药品的取用
1. “三不”原则:取用时不用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
2.节约原则:按规定用量取用。若没有说明用量,一般取最少量:液体1~2mL,固体只需盖满试管底部。
3.处理原则:实验用剩的药品既不能放回原瓶,也不要丢弃,更不能带出实验室,要放在指定的容器里
Ⅰ. 固体药品的取用
(1) 块状药品的取用 一横二放三慢竖 (将试管横放.用 将块状固体药品放入试管口,然后慢慢地将试管竖立起来,使块状固体缓缓滑至试管底部)。
横放容器,把药品放在容器口 把容器慢慢竖立起来,使药品顺着器壁滑到底部
(2) 粉末状药品的取用 一斜二送三直立(将试管倾斜,把盛有药品的药匙或纸槽送入试管底邵,然后使试管直立起来,让药品落入试管底部)。
Ⅱ. 液体药品的取用
(1) 多量取液:倾倒到指定容器液体药品:操作要领是:“取下瓶塞 着放,标签 缓慢倒,用完盖紧原处放。
口诀: 瓶塞倒放口对口,缓慢倒液签向手 。 轻刮残液塞紧塞,放回原处签朝外。
(2) 量取一定量的液体药品 量筒
俯视读数会使测量值偏大 仰视读数会使测量值偏小
量筒的使用
【注意事项】
1.量筒必须放平稳,读数时视线要与量筒内液体的凹液面的最底处相平。
2.量筒底无“0”刻度。
3.不能加热。
4.不能做反应器、不能溶解、稀释溶液。应根据量取液体体积的多少,选用大小适当的量筒。
(3) 少量取液——滴管
【注意事项】
1.使用滴管时,滴管不能伸入容器内,也不能接触容器内壁,应垂直于容器正上方。
2.取液后的滴管应保持橡胶胶帽在上,不要平放或倒放。
3.用过的滴管要立即用清水冲洗干净(滴瓶上的滴管不用冲洗)。
1、有10ml、50ml、100ml三种规格的量筒,如果要量取8ml的水,选择哪种量筒较好?
2、某同学量8ml的水时,读数时仰视,则该同学实际量取的水是大于8ml还是小于8ml ?
注意:读数时,只读出小数点后一位,如:8.4ml、55.3ml
三、给物质加热
观察下图,想一想使用酒精灯应注意什么事项?
1、酒精灯的使用方法
1),绝对禁止向燃着的酒精灯添加酒精
2),绝对禁止用燃着的酒精灯去点燃另一只酒精灯
3),熄灭酒精灯应用灯帽盖灭,不可用嘴去吹
4),万一不慎碰倒酒精灯, 应用湿抹布扑盖
小结:给物质加热的方法
2、小结
给物质加热的方法及注意事项:①加热玻璃仪器时,要把容器壁外的水擦干;②很热的容器不要立即用冷水冲洗.以免受热不匀而破裂;③给盛有液体的试管加热时,试管内液体的量不可超过试管容积的 ;④加热前应先 试管;⑤试管应 放在外焰上;⑥试管口不能朝着 的方向;⑦给试管里的固体药品加热时,试管口要略向 倾斜,受热均匀后再固定加热。
(3)给液体物质加热的仪器可用试管、烧杯、烧瓶等;给固体物质加热,可用干燥的试管。
1) 酒精不超过容积的三分之二 2)液体不超过试管容积的四分之一
3)与桌面成约450角 4)手不要拿试管夹的短柄
5)外壁有水,加热前要擦干 6)加热后不能马上用冷水冲洗
7)先预热,试管口不要对着自己或旁人 8)加热时,试管底部不要突然接触灯芯
9)试管夹要由下往上,夹在试管的中上部
注意:“焰心”和“灯芯”的写法
四、玻璃仪器的洗涤洗涤方法:
①倒去废物(要倒在指定的容器内);②用水冲洗并加以振荡;③用试管刷刷洗;④再用水冲洗。如果玻璃仪器内壁上附着不溶于水的碱、碳酸盐、碱性氧化物等,可先用稀盐酸溶解,再用水冲洗;如果玻璃仪器内壁附有油污,可用少量的量纯碱溶液或洗衣粉刷洗,再用水冲洗。
判别仪器干净方法:仪器上附着的水既不聚成水滴也不成股流下
选择合适的仪器填空:
1、常用作少量物质的反应容器,或给少量液体或固体加热的仪器是 试管 。
2、搅拌、过滤、蘸取液体时常用 玻璃棒 。
3、向NaOH溶液中逐滴滴入盐酸 胶头滴管 。
4、收集或贮存少量气体 集气瓶 。
5、取粉末状药品 药匙或纸槽 。
6、溶液蒸发、浓缩和结晶 蒸发皿 。
7、量取80mL的盐酸 量筒 。
8、将锌粒加入试管 镊子 。
9、取18克NaCl固体 托盘天平 。
10、往酒精灯里添加酒精 漏斗 。
11、拿到热的蒸发皿 坩埚钳 。
12、使烧杯、烧瓶均匀受热 石棉网 。
13、用于装配气体发生器,便于往装置中添加液体 长颈漏斗 。
14、给较大量加热,较大量物质反应容器,过滤中用于承接滤液 烧杯 。
注意事项
1.固体物质的加热
药品平铺在干燥的试管底部,
试管口略向下倾斜,
试管夹夹在距管口的1/3处,
先预热试管后,再用外焰集中对药品加热。
试管炸裂原因:没有预热,
试管外壁有水,试管口向上倾斜,
试管底部接触灯芯,加热后立即用冷水洗。
《走进化学世界》复习课教学案 学生版
化学是研究物质的 以及其 的科学。
学习化学的一个重要途径是 , 是科学探究的重要手段。
1.原子论和分子学说。 和 等科学家研究得出了一个重要结论:物质是由 和 构成的;分子的 和 的重新组合是化学变化的基础,即在化学变化中 会破裂,而 不会破裂,但可重新组合成新分子,即原子是参加化学变化的最小粒子。
2.组成物质的基本成分—元素。门捷列夫发现了 和 ,使化学学习和研究变得有规律可循。
3.绿色化学的主要特点。
(1)充分利用资源和能源,采用无毒、无害的原料。
(2) 在无毒、无害的条件下进行化学反应,以减少废物向环境排放。
(3) 提高原子的利用率,力图使所有作为原料的原子都被产品所 ,实现“ ”。
(4) 生产出有利于环境保护、社区安全和人体健康的环境良好产品。
4.了解几种高科技的化学产品 , 如具有超塑延展性的 ; 隔水透气的高分子薄膜;小猫安详地坐在高温火焰加热的平板上,也是高分子化学材料,其特点是具有绝热的性质;超强拉力的尼龙绳等。
一、对蜡烛及其燃烧的探究
结论:⑴蜡烛通常为黄白色的固体,密度比水 , 溶于水
⑵①蜡烛发出黄白色的火焰,放热、发光,蜡烛逐渐变短,受热时熔化,冷却后又凝固。
②木条处于外焰的部分最先变黑,外焰温度最 。
③烧杯内壁有水雾出现,说明蜡烛生成了 ,其中含有 元素;蜡烛燃烧后还生成 ,该气体能使 变 ,说明蜡烛中含有 元素。
④白瓷板上有黑色粉末出现,更说明蜡烛中含有 元素。
蜡烛燃烧的化学反应式是:
⑶有一股白烟,能重新燃烧。说明蜡烛燃烧是蜡烛气化后的蜡烛 被点燃。
二、对人吸入的空气与呼出的气体有什么不同的探究
结论:1.呼出的气体使石灰水出现的浑浊多,证明呼出的气体比空气中 的含量高。
2.呼出的气体使燃着的木条 灭,燃着的木条在空气中能够燃烧,证明空气中氧气的含量比 。
3.对着呼气的玻璃片上的水雾比放在空气中的玻璃片上的水雾 ,证明 。
一、物质的变化 物理变化 化学变化
1.物理变化:没有生成其它物质的变化。
特征:没有其他物质生成,仅是 的变化。
2.化学变化:变化时都生成了其它物质的变化(化学反应)。
特征:①有其他物质生成,常表现为颜色变化、放出气体、 生成沉淀
②常伴随能量变化,常表现为 、 、 等
3.两种变化的本质区别:变化中是否有其它物质生成。
4.联系:在化学变化的过程中,同时发生物理变化。
注意:判断物质变化不能仅仅依据是否有明显的现象,而应该看是否生成了其他物质,或者判断原物质的构成微粒有没有发生变化。有些化学变化是没有现象的,如一些中和反应,物理变化也可伴随有明显的现象如氧气液化时变成淡蓝色、电灯通电时发光也放热
二、物质的性质 物理性质 化学性质
1.物理性质:不需要发生 变化就表现出来的性质。如:颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性等。
2.化学性质:通过 变化表现出来的性质。如:可燃性、氧化性、还原性、稳定性、酸性、碱性等
注意:一般描述物质性质的语言中有“可、易、能、会”等表示具有能力的字眼,如镁带可以燃烧,糖能溶解与水。
练习:下列描述哪些是物理变化?哪些是化学变化?哪些是物理性质?哪些是化学性质?
A、铜绿受热时会分解; B、纯净的水是无色无味的液体;
C、镁带在空气中燃烧后变成了氧化镁; D、氧气不易溶于水且比空气密度大;
E、木棒受力折断; F、铁生锈; G、煤着火燃烧,残余一堆灰烬。
三、做好实验的要求
⑴课前要做好预习准备,明确实验要求。
⑵实验时要仔细观察,实事求是地做好记录,认真分析现象并做好实验报告。
⑶实验后的废物按要求处理,仪器要及时清洗,保持实验室整洁。
走进实验室:
一、常见仪器的使用:
蒸发皿、石棉网、坩埚钳、锥形瓶、长颈漏斗、药匙、胶头滴管、漏斗、干燥管、铁架台、试管、酒精灯、集气瓶、水槽、烧杯、量筒。
二、药品的取用
1.“三不”原则:取用时不用 药品,不要把鼻孔凑到容器口去 药品的气味,不得 任何药品的味道。
2.节约原则:按规定用量取用。若没有说明用量,一般取最少量:液体 ,固体只需盖满试管 。
3.处理原则:实验用剩的药品既不能 原瓶,也不要 ,更不能 实验室,要放在
的容器里
Ⅰ. 固体药品的取用
(1) 块状药品的取用 一横二放三慢竖 (将试管横放.用 将块状固体药品放入试管口,然后慢慢地将试管竖立起来,使块状固体缓缓滑至试管底部)。
横放容器,把药品放在容器口 把容器慢慢竖立起来,使药品顺着器壁滑到底部
(2) 粉末状药品的取用 一斜二送三直立(将试管倾斜,把盛有药品的药匙或纸槽送入试管底邵,然后使试管直立起来,让药品落入试管底部)。
Ⅱ. 液体药品的取用
(1) 多量取液 ——倾倒到指定容器液体药品:操作要领是:“取下瓶塞 着放,标签 缓慢倒,用完盖紧原处放。
口诀: 瓶塞倒放口对口,缓慢倒液签向手 。 轻刮残液塞紧塞,放回原处签朝外。
(2) 量取一定量的液体药品 量筒
俯视读数会使测量值偏 仰视读数会使测量值偏
量筒的使用
【注意事项】
1.量筒必须放 ,读数时视线要与量筒内液体的 相平。
2.量筒底无“ ”刻度。
3.不能加热。
4.不能做 、不能 、 溶液。应根据量取液体体积的多少,选用大小适当的量筒。
(3) 少量取液——滴管
【注意事项】
1.使用滴管时,滴管不能伸入容器内,也不能接触容器内壁,应垂直于容器正上方。
2.取液后的滴管应保持橡胶胶帽在上,不要平放或倒放。
3.用过的滴管要立即用 (滴瓶上的滴管不用 )。
1、有10ml、50ml、100ml三种规格的量筒,如果要量取8ml的水,选择哪种量筒较好?
2、某同学量8ml的水时,读数时仰视,则该同学实际量取的水是大于8ml还是小于8ml ?
注意:读数时,只读出小数点后一位,如:8.4ml、55.3ml
三、给物质加热
观察下图,想一想使用酒精灯应注意什么事项?
1、酒精灯的使用方法
1),绝对禁止向燃着的酒精灯添加酒精
2),绝对禁止用燃着的酒精灯去点燃另一只酒精灯
3),熄灭酒精灯应用 ,不可用嘴去吹
4),万一不慎碰倒酒精灯, 应用
小结:给物质加热的方法
2、小结
给物质加热的方法及注意事项:①加热玻璃仪器时,要把容器壁外的水擦干;②很热的容器不要立即用冷水冲洗.以免受热不匀而破裂;③给盛有液体的试管加热时,试管内液体的量不可超过试管容积的 ;④加热前应先 试管;⑤试管应 放在外焰上;⑥试管口不能朝着 的方向;⑦给试管里的固体药品加热时,试管口要略向 倾斜,受热均匀后再固定加热。
(3)给液体物质加热的仪器可用试管、烧杯、烧瓶等;给固体物质加热,可用干燥的试管。
1) 酒精不超过容积的三分之二 2)液体不超过试管容积的四分之一
3)与桌面成约450角 4)手不要拿试管夹的短柄
5)外壁有水,加热前要擦干 6)加热后不能马上用冷水冲洗
7)先预热,试管口不要对着自己或旁人 8)加热时,试管底部不要突然接触灯芯
9)试管夹要由下往上,夹在试管的中上部
注意:“焰心”和“灯芯”的写法
四、玻璃仪器的洗涤洗涤方法:
①倒去废物(要倒在指定的容器内);②用水冲洗并加以振荡;③用试管刷刷洗;④再用水冲洗。如果玻璃仪器内壁上附着不溶于水的碱、碳酸盐、碱性氧化物等,可先用 溶解,再用水冲洗;如果玻璃仪器内壁附有油污,可用少量的量 溶液或洗衣粉刷洗,再用水冲洗。
判别仪器干净方法:仪器上附着的水既不 也不
选择合适的仪器填空:
1、常用作少量物质的反应容器,或给少量液体或固体加热的仪器是 。
2、搅拌、过滤、蘸取液体时常用 。
3、向NaOH溶液中逐滴滴入盐酸 。
4、收集或贮存少量气体 。
5、取粉末状药品 。
6、溶液蒸发、浓缩和结晶 。
7、量取80mL的盐酸 。
8、将锌粒加入试管 。
9、取18克NaCl固体 。
10、往酒精灯里添加酒精 。
11、拿到热的蒸发皿 。
12、使烧杯、烧瓶均匀受热 。
13、用于装配气体发生器,便于往装置中添加液体 。
14、给较大量加热,较大量物质反应容器,过滤中用于承接滤液 。
注意事项
固体物质的加热
药品 在干燥的试管底部,
试管口略向下 ,
试管夹夹在距管口的 处,
先 试管后,再用 焰集中对药品加热。
试管炸裂原因:没有 热,
试管外壁有水,试管口向上倾斜,
试管底部接触灯芯,加热后立即用冷水洗。